История:
Аккумуляторы:
Батарейки:
Альтернативная энергия:
Разное:
Теория и её развитие:
Первые шаги Гальвани
Луиджи Гальвани появился на свет в Болонье 9 сентября 1737 года в семье, имеющей достаточно средств, чтобы в двадцать два года он смог закончить медицинский факультет Болонского университета. В нем он и остался преподавать. В 1763 году синьор Гальвани становится профессором. Он не только хороший лектор, но и анатом. На его счету не одна успешная хирургическая операция. И при всей своей загруженности Гальвани не бросает занятий наукой. В 1780 году он начинает исследования по физиологии нервов и мышц.
Предоставим слово самому синьору профессору. В первой части "Трактата о силах электричества при мышечном движении", вышедшего из печати в 1791 году, он пишет:
"Я разрезал и препарировал лягушку и, имея в виду совершенно другое, поместил ее на столе, на котором находилась электрическая машина при полном разобщении от кондуктора последней и довольно большом расстоянии от него. Когда один из моих помощников острием скальпеля случайно очень легко коснулся внутренних бедерных нервов этой лягушки, то немедленно все мышцы конечностей стали так сокращаться, что казались впавшими в сильнейшие тонические судороги. Другой помощник заметил, что это удается тогда, когда из кондуктора машины извлекается искра. Удивленный новым явлением, он тотчас же обратил на него мое внимание, хотя я замышлял совсем другое и был поглощен своими мыслями. Тогда я зажегся невероятным усердием и страстным желанием исследовать это явление и вынести на свет то, что было в нем скрыто".
Едва ли не самое любопытное в этой истории то, что у Гальвани не должно было быть причин приходить в столь большое волнение. Лет за тридцать до него сокращение лягушачьей лапки поблизости от электрической машины наблюдал и описал Марко Кальдани, не придавший, впрочем, этому никакого значения. А в 1678г. физиолог Шваммердам демонстрировал герцогу Тосканскому, как содрогаются лапки лягушки, подвешенной на серебряной нити. К счастью, Гальвани ничего этого не знал, то, что он увидел, его взволновало, и он решил доискаться до причин странного явления.

Экспериментальный стол Луиджи Гальвани
Может возникнуть вопрос - зачем на препараторском столе стоят электрическая машина и лейденские банки?
Середина XVIII века была отмечена всеобщим увлечением электрическими опытами со статическим электричеством. Их количество должно было дать качественный скачок. Электризацией пробовали не только выводить цыплят, но и лечить людей. Врачи электризовали лекарства, пациентов и, независимо от результатов, писали о "безусловно положительном эффекте". Кстати, ведь и лейденскую банку открыли, желая "зарядить" микстуру от кашля. К описываемому времени возникло немало "целителей", убеждавших, что они обладают особенно сильным электрическим воздействием и потому могут исцелять больных. Возникли даже "методики лечения", согласно которым расслабленных (парализованных) людей нужно заряжать для излечения положительным электричеством, а безумных - отрицательным. Теперь понятно, почему на столе у Гальвани появился такой модный прибор, как электрическая машина. Она была ему необходима для медицинских экспериментов.
Обнаружив влияние электричества на лягушачьи лапки, Гальвани предположил, что все дело в электрических искрах. Но если слабая искра электрической машины заставляет лягушачью лапку вздрагивать, то что должно произойти во время грозы, при блеске молнии? Надо только дождаться грозы. И когда желаемая погода наступила, ассистенты синьора профессора тотчас же отправились к соседнему пруду, откуда обычно черпали материал для опытов. Правда, злые языки утверждали, что после показа студентам мясистые лапки частенько шли в кастрюльку, обеспечивая не только духовную пищу.
Так или иначе, но к началу грозы на железной ограде балкона лаборатории висела впечатляющая гирлянда лягушачьих лапок, насажденных на медные проволочки. Наконец подул ветер. Забарабанил дождь, и блеснула первая молния. Отрезанные лапки исправно задергались, правда, не сильнее, чем в лаборатории, и совсем не в такт с разрядами небесного электричества. Все же эксперимент удовлетворил Гальвани.
Гальвани решил попробовать, как действует на мышцу атмосферное электричество, когда нет грозы. Он всадил в спинной мозг препарированной лягушки медный крючок и повесил ее на железную решетку своего балкона. Ничего не случилось. Устав от ожидания, Гальвани стал давить на крючок, прижимая лягушку к решетке. К немалому изумлению, ибо дело было при ясном небе, он заметил, что лягушка начинала дергаться. Тогда он решил, что атмосферное электричество скопилось в лягушке, а потом вышло из нее при соприкосновении с металлом.
Описание опыта изложенное самим Гальвани:
"После успешных опытов во время грозы я пожелал обнаружить действие атмосферного электричества в ясную погоду. Поводом для этого послужило наблюдение, сделанное над заготовленными лапками лягушки, которые, зацепленные за спинной нерв медным крючком, были повешены на железную решетку забора моего сада: лапки содрогались не только во время грозы, но иногда, когда небо было совершенно ясно. Подозревая, что эти явления происходят вследствие изменения атмосферы в течение дня, я предпринял опыты. В различные часы в продолжение ряда дней я наблюдал нарочно повешенную на заборе лапку, но не обнаружил каких-либо движений в ее мускулах. Наконец, утомленный тщетным ожиданием, я прижал медный крюк, который был продет в спинной мозг, к железной решетке, желая посмотреть, не возникнут ли благодаря этому приему мышечные движения и не обнаружат ли они в чем-нибудь отличия и изменения, смотря по различному состоянию атмосферы и электричества".
Гальвани перенес эксперименты в помещение. Он помещал лягушачьи лапки на подставки из различных металлов. В одних случаях сокращения были сильнее, в других - слабее. Он пытался экспериментировать с деревянной дощечкой в качестве подложки, со стеклом, смолой. Эффект не наблюдался. Казалось бы, все подталкивало к тому, чтобы исследовать роль разнородных металлов в обнаруженном явлении. Но Гальвани по этому направлению не пошел. Анатом и физиолог, он решил, что лягушачьи лапки сами являются не чем иным, как источником особого вида электричества, неким подобием лейденской банки. В своем дневнике Гальвани написал:
"Это было несколько неожиданно и заставило меня предположить, что электричество находится внутри животного".
Металлы же в его понимании были попросту проводниками открытого им нового "животного электричества".
Эксперименты Гальвани повторяли буквально во всех странах. Лягушки погибали тысячами во славу новой науки. Современники писали:
"В течение целых тысячелетий хладнокровное племя лягушек беззаботно совершало свой жизненный путь, как его наметила природа, зная только одного врага, господина аиста, да еще, пожалуй, терпя урон от гурманов, которые требовали для себя жертвы в виде пары лягушачьих лапок со всего несметного рода. Но на исходе XVIII столетия наступил злосчастный век для лягушек. Злой рок воцарился над ними, и вряд ли когда-либо лягушки от него освободятся. Затравлены, схвачены, замучены, скальпированы, убиты, обезглавлены - но и со смертью не пришел конец их бедствиям. Лягушка стала физическим прибором, отдала себя в распоряжение науки. Срежут ей голову, сдерут кожу, расправят мускулы и проткнут спину проволокой, а она все еще не смеет уйти к месту вечного упокоения; повинуясь приказаниям физиков или физиологов, нервы ее придут в раздражение и мускулы будут сокращаться, пока не высохнет последняя капля "живой воды". И все это лежит на совести у Алоизо Луиджи Гальвани".
Со временем от лягушачьих лапок экспериментаторы переключились к конечностям кроликов и овец, испытывали действие электричества на ампутированной человеческой ноге. Английский врач из Глазго на публичной лекции приложил электроды от батареи лейденских банок к нервам и мышцам трупа повешенного и воспроизвел у него дыхательное движение грудной клетки. А когда мертвец под действием электрического разряда открыл глаза и лицо его стало вздрагивать, многие из присутствующих лишились сознания от ужаса.
Казалось, оставалось совсем чуть-чуть до исполнения вековечной мечты человечества. Для этого надо было только тщательно исследовать "животное электричество Гальвани", отыскать его источник в теле и научиться заряжать этот источник, когда он иссякает со смертью.
Утверждая, что он обнаружил именно новый вид электричества, Гальвани приводил в пример электрических рыб. Их способность наносить ощутимые удары была известна с глубокой древности. Есть свидетельства, что уже римские врачи помещали парализованных больных с целью излечения в бассейны с электрическими скатами. А когда испанские мореплаватели достигли берегов Америки и худо-бедно познакомились с природой Нового Света, то в XVII веке были сделаны описания электрического угря.
Когда выяснилось, что электрический удар от разряда лейденской банки такой же, как от прикосновения к электрическому скату, французский ботаник Марсель Адансон сделал предположение, что и то и другое имеет одинаковую природу.
Проверяя высказанную гипотезу, английский физик Дж. Уолш выяснил, что удар электрического ската передается по металлическому проводнику, но не передается через стекло, дерево и прочие изоляторы. Он даже наблюдал искры, проскакивающие между полосками фольги, наклеенными на теле ската, при разряде, и повторил опыт аббата Нолле, пропустив разряд (теперь уже не удар, а разряд) электрической рыбы через нескольких добровольцев. Этим была почти доказана электрическая природа явления.
Еще за десять лет до экспериментов Гальвани гениальный ученый-одиночка Кавендиш присоединил проволочки к брюху и спине ската и с помощью электроскопа с бузинными шариками измерил заряд на теле рыбы. Но Кавендиш никогда не публиковал результаты своих экспериментов.
Занимался электрическими рыбами и Гальвани. Одна из них даже носит сегодня его имя - "торпедо Гальвани". Эти опыты лишь утвердили его во мнении, что если скаты могут вырабатывать электричество, то его должны давать и мышцы любого иного животного. При этом болонский профессор подчеркивал в своем трактате, что считает электричество, появляющееся при трении, так же как атмосферное и электричество скатов, сходным с "животным электричеством", которое открыл он.
Сначала Гальвани вел только дневники собственных опытов. Но через десять лет он решил объединить результаты исследований и выпустил "Комментарий о силах электричества в мускульном движении". Книга возбудила большой интерес среди физиков и врачей, наперебой повторявших описанные эксперименты. Уже давно было известно, что электрические разряды от машин и лейденских банок вызывают конвульсии у людей, подвергавшихся их ударам. И хотя природа таких явлений оставалась неисследованной, медики-практики широко пользовались "электрической жидкостью" для лечения своих больных от всевозможных недугов.
Повсюду, где только водились лягушки, и где можно было раздобыть два куска разнородного металла, каждый хотел собственными глазами убедиться в чудесном воскрешении отрезанных членов.
В 1791г., когда был опубликован труд Гальвани, сорокашестилетний профессор университета в Павии Алессандро Вольта, только что принятый в члены Лондонского Королевского общества, приступил к экспериментам с изобретенным им электроскопом, а тридцатилетний Василий Петров начал преподавать физику в Измайловском кадетском училище в Петербурге. Гэмфри Дэви исполнилось 13 лет, Берцелиусу - 12, а Майкл Фарадей только появился на свет. Все еще было впереди.
Вольта против Гальвани
В самый разгар триумфа гальванизма появилась в итальянском "Физико-медицинском журнале" статья профессора физики Павийского университета Алессандро Вольты. Тот утверждал, что для объяснения опытов Гальвани не нужно предполагать существование какого-то особого "животного электричества". Дело совсем не в бедной лягушке и не в ее отрезанной ноге. Просто Гальвани, сам того не подозревая, привел во взаимодействие два различных металла. Они и породили электрическую силу. А лягушка послужила только проводником.
"Я давно убедился, - писал Вольта в письме к профессору Вассали, - что все действие возникает первоначально вследствие прикосновения металлов к какому-нибудь влажному телу или к самой воде. В силу такого соприкосновения электрический флюид гонится в это влажное тело или в воду от самих металлов, от одного больше, от другого меньше (больше всего от цинка, меньше всего от серебра). При установлении непрерывного сообщения между соответствующими проводниками этот флюид совершает постоянный круговорот. И вот, если в состав этого проводящего круга или в какую-нибудь его часть входят в качестве соединительного звена бедренные нервы лягушки, рассеченной таким образом, что только по одним этим нервам должен пройти весь или почти весь электрический ток, или если таким звеном является какой-нибудь другой нерв, служивший для движения того или иного члена тела какого-либо другого животного, пока и поскольку такие нервы сохраняют остаток жизнеспособности, то тогда, управляемые такими нервами, мышцы и члены тела начинают сокращаться, как только замыкается цепь проводников и появляется электрический ток; и они сокращаются каждый раз, когда после некоторого перерыва эта цепь снова замыкается".
Вольта был к тому времени довольно известен своими исследованиями газов, а также несколькими выдающимися экспериментальными работами по электричеству, был членом Лондонского королевского общества. Вначале он, как и все, был убежден в правильности взглядов Гальвани. Но, воспроизводя опыты коллеги, стал испытывать сомнения. Гальвани, считая, что именно в мышце, как в лейденской банке, накоплено "животное электричество", всегда прикладывал металлический проводник одним концом к мышце, а другим к нерву и наблюдал сокращение лягушачьей лапки как следствие разряда.
Вольта обнаруживает, что еще лучше сокращение происходит, когда проволока, состоящая из двух разных металлов, замыкает не мышцу и нерв, а два участка препарированного нерва. Не значит ли это, что вовсе не в мышце скапливается "животное электричество", а сам нерв передает в мышцу "электрический флюид". В те времена электричество считалось некой невесомой жидкостью - флюидом. И почему замыкающий проводник должен состоять из двух разных металлов? Не в них ли дело? Вольта начинает изучать сочетания разных пар металлов и приходит к выводу, что не мышца лягушки, а два металла "являются в настоящем смысле слова возбудителями электричества, между тем как нервы играют чисто пассивную роль".
Естественно, что Гальвани не мог оставить такой выпад без внимания. В присутствии свидетелей он препарировал лягушек железным ножом, положив их на железную же подставку, соединял мышцу и нерв проводом из одного металла. Лапки все равно дергались. "Если это происходит и при одном металле, значит, источник электричества находится в животном!" - убеждал Гальвани.
"Отнюдь! - возражал Вольта. - Даже единый кусок проволоки нельзя считать абсолютно однородным. В нем могут быть примеси. Он может быть по-разному закален по длине". И демонстрировал электричество, которое рождалось вообще без участия животных, из одних лишь разнородных металлов. Вольта окрестил его "металлическим электричеством".
Весь мир физиков поделился на два лагеря. Одни поддерживали Гальвани и назывались сторонниками гальванизма. Другие придерживались взглядов Вольты. И трудно сказать, чем бы кончился этот спор в XVIII веке, однако Гальвани из поединка выбыл.
В 1796 году в Северную Италию под предлогом войны с Австрией вторглись французские войска под командованием генерала Бонапарта. Болонья вошла в состав новой Цезальпинской республики. Все профессора университета обязаны были принести присягу на верность новому правительству. Подавляющее большинство так и сделало. Те же, кто не смог вовремя проявить гибкость, были уволены. Остался без работы и Гальвани, который не смог вынудить себя принести присягу на верность новому политическому строю. Потеряв за несколько лет до этого жену, покинутый учениками, он остался совсем одиноким, без средств к существованию. Говорили даже, что он терпел нужду и на шестьдесят первом году жизни скончался от истощения. Другими словами - от голода.
Ошибался ли Гальвани в собственных взглядах на "животное электричество"? Ни в коем случае! Итальянский ученый по праву считается одним из основателей учения об электричестве. И его опыты с "животным электричеством" составляют основу нового научного направления - электрофизиологии, исследующей электрические явления в живом организме. Электрические процессы лежат в самой основе жизни. Тут и возбуждение нейронов, например в процессах зрения, и передача нервного импульса, электрические процессы в мозге - энцефалография, и так хорошо знакомое нашему веку электрическое исследование работы сердечной мышцы - электрокардиография... Нет, лягушки болонского профессора, как и собаки Павлова, вполне заслужили памятник. А сам Луиджи Гальвани навсегда останется в памяти человечества.
Недалеко от Милана, у городка Комо, находится деревня Камнаго. Здесь было родовое имение семейства Вольта. В 1745 году на рассвете в господском доме увидел свет хилый младенец, нареченный отцом-капелланом именем Алессандро. У аристократической четы было семеро детей. Алессандро считался самым неудачным, он был слаб здоровьем и сильно отставал от своих ровесников в развитии. Кроме того, он был упрям. Отданный на воспитание почтенной женщине - жене мастера физических приборов, мальчик до четырех лет не произносил ни слова. И окружающие уже приготовились считать его немым.
По-видимому, в доме своей ранней воспитательницы будущий физик познакомился впервые и с физической аппаратурой. И как это часто бывает, впечатления детства установили направление всей жизни. Ему еще не было и восемнадцати лет, когда, поставив ряд опытов по электричеству, он пришел к заключению, что многие из результатов можно объяснить законами Ньютона. Воодушевленный этой идеей, он написал письмо самому аббату Нолле во Францию. Тот откликнулся, одобряя начинания молодого человека. Это одобрение послужило немалым стимулом для Вольты. В двадцать четыре года он написал диссертацию, основой которой послужили опыты с лейденской банкой. А спустя десять лет стал профессором физики в университете города Павии.
Вольта увлекся экспериментированием. Недюжинный изобретательский талант позволяет ему улучшать свои и чужие придумки, доводить их до такого изящества, которое вызывало восторг бедного на физические приборы времени. Вольта изобрел очень чувствительный соломенный электроскоп и сделал ряд выдающихся изобретений в сфере химии. Все шире становилась его переписка. Вольта много путешествовал, знакомился с выдающимися учеными своего времени. Научные общества наперебой выбирали его своим членом. Еще бы: богатый, знатный, хорошо образованный, в детстве без труда получивший все то, что выходцам из низов приходилось выбивать себе в зрелом возрасте, расходуя на это и силы, и время.
Трактат Гальвани изумил Алессандро. И первое время, проверяя все описанные соотечественником опыты, Вольта был вполне на стороне болонского профессора. Однако большой личный опыт экспериментирования препятствовал ему полностью признать позиции Гальвани. А тут еще как-то подвернулась ему книжка швейцарского врача Жан-Жака Зульцера, который писал:
"Если два куска металла, один оловянный, другой серебряный, соединить таким образом, чтобы оба края их были на одной плоскости, и если приложить их к языку, то в последнем будет ощущаться некоторый вкус, довольно похожий на вкус железного купороса, в то же время каждый кусок металла в отдельности не дает и следа этого вкуса..."
Он заменяет лягушку своим языком и ощущает, как он пишет "вкус электричества". На середину языка он кладет золотую монету или серебряную ложку, а к кончику языка прикладывает чистую оловянную пластинку и приводит ее в контакт с монетой или ложкой. При этом он ощущает "такой же кисловатый вкус, что и при приближении языка к кончику искусственно наэлектризованного проводника..."
Он поставил следующий эксперимент: четырех своих помощников он поставил на смолу, чтобы изолировать от земли. Первому из стоящих велел взять в мокрую правую руку цинковую пластинку, а левой коснуться языка своего соседа. Тот, в свою очередь, должен был мокрым пальцем коснуться глазного яблока следующего. Третий и четвертый держали в руках свежепрепарированную лягушку. И кроме того, у четвертого в свободной мокрой руке была зажата серебряная пластинка. Когда серебро касалось цинка, язык второго чувствовал кислый вкус, в глазу у третьего вспыхивало световое пятно, лапки лягушки между третьим и четвертым начинали дергаться. Превосходный результат! Разве не доказывает он, что никакого "животного электричества" не существует? Все дело в контакте различных металлов.
После статьи в "Физико-медицинском журнале" в 1794 г., где он утверждал, что надо говорить не о "животном" электричестве, а об электричестве "металлическом", оставалось дожидаться только одного: появления технического устройства из металлов, генерирующего электрический ток. Но идеи подобного устройства у Вольты в то время не было. Прошло пять лет, наполненных опытами, дискуссиями, размышлениями, сомнениями. Но вот в самом конце 1799 г. Вольта изготавливает источник электрического тока из двух разнородных металлов, разделенных влажным телом. Это был вольтов столб.
Мощность столба зависела от числа элементов. Но при большом количестве дисков столб становился неустойчивым, и Вольта придумал для него специальную ограду из четырех прутьев, не проводящих ток, или делил столб на несколько частей. Самым лучшим оказался "столб", который Вольта назвал "прибором из цепи чашек". Несколько десятков чашек, заполненных соленой водой, объединялись металлическими дугами, которые делались из двух металлов - меди и цинка. Оба металла были спаяны выше места их погружения в раствор. Один конец дуги помещался в одну чашку, другой - в другую, так что в средних чашках оказывались два разных металла.
Какие бы конфигурации Вольта ни придавал своему столбу, он убеждался, что два разнородных металла, разделенные "влажным телом", представляют собой новый источник электричества, о котором раньше никто не знал.
Предоставим слово современнику той поры - выдающемуся французскому ученому Араго, написавшему биографию Вольты:
"В начале 1800 года вследствие теоретических соображений знаменитый профессор придумал составить длинный столб из кружков: медного, цинкового и мокрого суконного. Чего ожидать заранее от такого столба? Это собрание, странное и, по-видимому, бездействующее, этот столб из разнородных металлов, разделенных небольшим количеством жидкости, составляет снаряд, чуднее которого никогда не изобретал человек, не исключая даже телескопа и паровой машины".
20 марта 1800 года профессор естественной философии Алессандро Вольта послал письмо президенту Лондонского королевского общества сэру Джозефу Бэнксу, баронету. Путь от Павии до Лондона неблизкий, а почтовые кареты по дорогам Европы катились неторопливо. Поэтому точно сказать, когда послание пришло в столицу Британского королевства, трудно. Но в конце концов сэр Джозеф получил запечатанный пакет, вскрыл его и прочитал. Письмо было озаглавлено: "Об электричестве, возбуждаемом простым соприкосновением различных проводящих веществ". Вот отрывок из этого письма:
"После долгого молчания, в котором я не пытаюсь оправдываться, имею удовольствие сообщить Вам, синьор, а через Ваше посредство и Королевскому обществу о некоторых поразительных результатах, полученных мною... Главный... это создание прибора, который по своим действиям, то есть по сотрясению, испытываемому рукой и т.п., сходен с лейденской банкой или со слабо заряженной электрической машиной, но который, однако, действует непрерывно, одним словом, дает непрерывный поток электрического флюида".
Хотя президент общества был доктором юридических наук и членом королевского тайного совета, а основным событием в его жизни было "кругосветное" путешествие, совершенное с капитаном Куком, и главной заслугой считалось основание Африканского общества, он не был чужд и проблемам естествознания, заботивших его современников. Не очень разобравшись в излагаемых Вольтой темах, сэр Джозеф показал письмо друзьям - лондонскому врачу сэру Энтони Карлейлю и бывшему чиновнику Ост-Индской компании, инженеру и любителю естествознания Уильяму Никольсону. 30 апреля Никольсон и Карлейль смастерили по описаниям Вольты столб из семнадцати пластинок и сразу же принялись за эксперименты. Налив каплю воды в углубление цинковой пластинки для осуществления лучшего контакта с проволокой, экспериментаторы заметили, что, когда цепь замыкалась, в воде появлялись пузырьки. Никольсон понюхал и сказал, что похоже на запах водорода. Он взял стеклянную трубку, налил в нее свежей ключевой воды и заткнул пробками, через которые пропустил латунные проволоки. Далее присоединил обе проволоки к противоположным полюсам вольтова столба. И тотчас от конца одной из проволок побежали в воде пузырьки газа, а вторая проволочка на глазах начала темнеть и покрываться налетом. Непонятно, но любопытно. Джентльмены смешали полученный газ с равным количеством воздуха и подожгли. Раздался взрыв... Водород! Безусловно водород. Ведь это один из газов, входящих в состав воды.
26 июня этого же года, несмотря на лето, сэр Джозеф Бэнкс на собрании членов общества обнародовал письмо Вольты. А Карлейль с Никольсоном продемонстрировали опыт по разложению воды. Их работа произвела сенсацию. Ученые и до того знали о возможности разложения воды электрической искрой. Но здесь процесс проходил непрерывно! А изготовить "снаряд" Вольты было так просто!..
Письмо Вольты было опубликовано в "Философских трудах" Королевского общества и мир узнал о появлении химического источника тока.
С быстротой молнии разлетелась новость по научным кругам Европы. Все уважающие себя физики взялись за сооружение вольтовых столбов и за их испытание. Еще бы, такая новость - "снаряд" итальянского изобретателя беспрерывно вырабатывал электричество совсем не так, как это делали электрические машины. Там его нужно было накапливать, а здесь оно тихо текло и текло беспрерывным потоком.
Экспериментаторы писали о разложении с использованием электричества многих растворов солей с выделением металлов на отрицательном полюсе вольтова столба.
20 октября 1800 года князь Дмитрий Алексеевич Голицын, чрезвычайный русский посланник в Гааге, написал на имя президента Петербургской академии наук Генриха Людвига Николаи письмо. В нем он осведомлял: "Гальванисты открыли весьма любопытное электрическое явление. Цинковые и серебряные пластинки, положенные попеременно друг на друга и отделенные друг от друга слегка смоченной фланелью, производят толчок и даже электрические искры". Сам Николаи не интересовался физикой. Но письмо нашло своего адресата. Потому что ровно через год произошло в русской столице событие, о котором сохранилась запись в "Санкт-Петербургских ведомостях" за 1 октября 1801 года. В ней говорилось, что на заседании конференции Академии наук вицепрезидент Бергколлегии и член Лондонского королевского общества граф Аполлос Аполлосович Мусин-Пушкин, известный своими трудами в сфере химии, минералогии и физики, показал немало "куриозных экспериментов с вольтовым столбцом, состоявшим из 150 элементов". Для тех времен это была весьма внушительная батарея. Присутствовавшие немало изумлялись искусству экспериментатора.
Осенью 1800 года профессору Алессандро Вольте пришло приглашение из Парижа прочесть курс лекций перед виднейшими физиками Франции. Путь от Павии до Парижа не слишком долог. Но эта поездка превратилась в сплошной триумф. Каждый город, в который он приезжал, желал выразить ему свое восхищение. В Женеве в Обществе естествоиспытателей приезжий прочел доклад о "тождестве гальванизма с обыкновенным электричеством". "Обыкновенным" в ту пору считали электричество, получаемое в процессе трения. А ведь были еще эксперименты с турмалином. Было "животное электричество" морских скатов и американских угрей, "атмосферное электричество". И теперь еще этот странный вольтов столб. Тут было от чего прийти в сомнение.
В Парижской академии наук организовали специальную комиссию по изучению гальванизма. В нее вошли самые известные ученые. Они соорудили по описаниям вольтов столб и повторили все эксперименты итальянского исследователя перед его приездом. Погрузив один из концов "электродвигательного прибора" в воду и присоединив к другому его концу металлическую проволоку, академики засовывали руку в чашку с водой и одновременно прикладывали второй электрод к языку, к веку, к кончику носа или на лоб. В момент замыкания цепи следовал такой удар, что некоторые чуть не лишались языка. Но... наука требует жертв. Ощущения были настолько неожиданными! При наложении проволоки на веко создавалось ощущение вспышки. А когда два электрода от противоположных полюсов батареи вставляли в уши, в голове раздавался шум... "Это было нечто вроде треска или лопанья, как если бы кипело какое-то масло или вязкое вещество", - писал сам Вольта. Он полагал, что в дальнейшем его прибор сможет послужить медикам для излечения болезней. Другого применения гальваническому электричеству он не представлял.
Хочется надеется, что у читателя этой статьи не появится желание повторить эксперименты уважаемых ученых того времени, с засовыванием электродов в уши или глаза.
Не было, как будто, таких наград, которые не получил бы в Париже итальянский исследователь. Наполеон оказывал ему такое особое внимание, что это спровоцировало немалую ревность со стороны французских коллег. И Вольта, умный и дальновидный, заспешил домой. В 1815 году он перешел в Падуанский университет, в котором принял пост директора философского факультета. Последние годы своей жизни Вольта прожил скромно. Ничего существенно нового для науки не совершил. В 1819 году вышел в отставку и ушел на покой в родной Комо.
Вольта был не особенно силен в области теории. Тем не менее причины, возбуждающие электрический ток в вольтовом столбе, он должен был объяснить. И он предложил так называемую контактную теорию, которая утверждала, что электрический ток возбуждается в результате контакта металлов. Достаточно одного лишь соприкосновения разнородных металлов, утверждал Вольта, чтобы появилась "электродвигательная сила", которая разделяет соединенные положительное и отрицательное электричества и гонит их в виде токов в противоположных направлениях.
Многие пробовали доказать, что электрический ток возбуждается в результате химических процессов в вольтовом столбе. Но должно было пройти более тридцати лет, потребовался приход в науку Фарадея, чтобы в этот вопрос была внесена ясность. Но к тому времени итальянский исследователь Алессандро Вольта уже лежал в фамильном склепе на кладбище того же города, где и увидел свет.
В седьмом номере "Северного вестника" за 1804 г. в заметке "Краткое обозрение С.-Петербургской Медико-хирургической академии" сообщалось:
"Медицинская коллегия... в 1802 году по представлению профессора Петрова определила достаточную сумму для приготовления огромной гальванической батареи. Посредством таковой батареи сей неутомимый отечественный наш физик делал в присутствии Медицинской коллегии и многих знаменитых особ первые публичные опыты сего года мая 17 дня"
Профессор Петербургской медико-хирургической академии Василий Владимирович Петров (1761-1834) не желал повторять эксперименты своих иностранных коллег с вольтовой батареей. Он решил изучить явления, которые будет создавать очень большой и мощный столб. Именно на этом пути ему было суждено сделать открытие большой важности.
Не сохранилось его писем, дневников, его личных вещей. Нет воспоминаний о нем. Есть только его труды. Есть его послужной список, всякие докладные записки, отчеты, отзывы - то, что положено хранить в архивах, тот прерывистый служебный след, какой остается от каждого служивого человека. Это он, Василий Петров, создал невиданный до того физический кабинет для исследований при Медико-хирургической академии.
Результаты исследований с вольтовым столбом Петров описал в известной книге "Известия о гальвани-вольтовских опытах", вышедшей в Петербурге в ноябре 1803 г. Эта книга, так же как и другие работы В. В. Петрова, написана прекрасным языком. Он писал в введении:
"сколько мне известно, доселе никто еще на российском языке не издавал в свет и краткого сочинения о явлениях, происходящих от гальвани-вольтовской жидкости, то я долгом моим поставил описать по-российски деланные самим мной важнейшие и любопытнейшие опыты посредством гальвани-вольтовской батареи"
Петров внес значительные усовершенствования в конструкцию вольтова столба. Новый столб состоял из 4200 медных и цинковых кружков диаметром 3,5 сантиметра. Если бы их можно было положить друг на друга, то высота батареи превзошла бы 12 метров. Петров заметил, что даже при двухстах пластинках в таком столбе электролит (он применял нашатырь, которым пропитывал бумажные прокладки) выжимался из бумажных дисков, находящихся в его нижней части, и действие батареи ослабевало. Поэтому он расположил свою батарею горизонтально в специальном ящике из красного дерева. Кружки были поставлены на ребро и уложены в четыре соединенных последовательно ряда. Внутренняя поверхность ящика была покрыта изоляцией - сургучным лаком. Все это делало столб довольно мощным, долговечным и удобным для использования. После Петрова многие ученые стали создавать горизонтальные вольтовы батареи. По современным оценкам батарея Петрова давала напряжение около 1500В.
Мощный источник тока позволил Петрову провести всевозможные исследования и сделать несколько открытий и наблюдений. Он установил, что различные вещества по-разному ведут себя при электролизе, что для разложения воды, например, хватит батареи из двух пар пластинок, а для разложения масла и спирта требовалась вся его колоссальная батарея из 4200 пар. Оказалось, что на электролиз и на работу батареи значительное влияние оказывает температура. Он писал, что отдавшая на холоде весь свой запас электроэнергии батарея "оживает", если внести ее в теплое помещение: "...вовсе прекратившееся или, по крайней мере, весьма ослабевшее ее действие опять становилось постепенно чувствительнее..."
Изучая разложение жидкостей электрическим током, Петров один из первых заметил, что материал электродов разлагается так же, как и жидкость (он считал, что металлические электроды, к которым подключен "плюс" батареи, окисляются). Исследуя влияние материала электрода на реакцию, он отметил, что изменение окраски жидкости у электрода зависит от природы металла, из которого сделан электрод. Одним из первых он научился выделять с помощью электрического тока металлы из растворов их солей.
Экспериментировал Петров с энтузиазмом и был на редкость изобретателен при разработке методики исследования. Не забудем, что в те времена приборов было немного, ни амперметров, ни вольтметров не было. Качество работы батареи Петров узнавал по своеобразному ощущению, которое вызывал электрический ток в его пальцах, когда он касался ими столба. Чтобы сделать пальцы более чувствительными, он срезал с их кончиков верхний слой кожи; тогда ему удавалось выявить даже очень слабый ток.
Петров разработал метод изоляции провода сургучом, а также способ изготовления многожильного гибкого провода с изоляционным покрытием. Несколько тонких струн Петров обвивал медной проволокой или шелковой ниткой, а потом покрывал тонким слоем воска.
Намного раньше других Петров использовал параллельное соединение проводников, при котором электрический ток, "входя одновременно во все из них и покидая их через соединенные вместе концы", производил более сильное действие.
В "Известиях о гальвани-вольтовских опытах" была впервые в мире описана электрическая дуга, появляющаяся при сближении двух угольков, соединенных с источником тока:
"Если на стеклянную плитку будут положены два древесных угля и если потом металлическими изолированными направителями, сообщенными с полюсами огромной батареи, приближать оные один к другому на расстояние от одной до трех линий (линия - старая русская мера длины, равная приблизительно 2,5 мм.), то является между ними весьма яркий белого цвета свет или пламя, от которого оные угли скорее или медленнее загораются, и от которого темный покой довольно ясно освещен быть может".
Открытие Петрова не привлекло большого интереса. А описание эксперимента, изложенное в "Известиях Академии" на русском языке, скорее всего, осталось неизвестным большинству европейских ученых. Совсем другая судьба у повторившегося открытия той же дуги в Англии. Несколько лет спустя, чрезвычайно удачливый и, безусловно, талантливый ученый Гемфри Дэви, чьим учеником потом станет Майкл Фарадей, независимо от Василия Петрова обнаружил то же явление и показал его коллегам по Лондонскому королевскому обществу. Вот тут недостатка во внимании и восторге не было.
Практическое применение дуга Петрова нашла прежде всего в осветительной технике. В 1875 г. талантливый изобретатель Павел Николаевич Яблочков (1847-1894), разместив угли параллельно и разделив промежуток между ними изолирующим веществом, способным испаряться по мере их горения, создал "электрическую свечу". "Русский свет", как прозвали изобретение Яблочкова за границей, впервые осветил парижскую площадь Опера, шикарные парижские магазины, туманные набережные Темзы, шумный порт в Гавре. Позднее свечи Яблочкова горели на Литейном мосту и на Екатерининской площади в Петербурге, на Балтийском, Путиловском, Обуховском и других заводах. По инициативе В. Н. Чиколева, основателя Московского политехнического музея, дуга Петрова была приспособлена для прожекторов во время русско-турецкой войны. Большего дуговые лампы не достигли. На замену им пришли простые и дешевые лампы накаливания. Но все же электрическая дуга нашла самое широкое применение в электросварке и электрометаллургии.
Самым первым гальваническим элементом был Вольтов столб, о котором есть отдельная статья. Потом стали появляться другие, но все они имели серьезный недостаток. Первые гальванические элементы вырабатывали ток только несколько минут, потом их приходилось отключать от нагрузки, чтобы они "отдохнули". Тогда не могли понять из-за чего это происходит. Кратковременная работа источников тока создавала серьезные препятствия для использования в промышленности. Поэтому основной задачей многих экспериментаторов стало увеличение времени работы гальванических источников тока. Изобретателей химических источников тока было много, и, патентуя свое изобретение, каждый давал ему свое имя.
Проблема была в так называемой поляризации электродов проявляющейся в различных явлениях, например в появление на электроде пузырьков газа затрудняющих движение ионов у электрода или в изменении концентрации ионов у электрода. В дополнение к поляризации вызванной подключением элемента к нагрузке, у использующегося в то время довольно мощного гальванического элемента (цинковый и медный электроды погруженные в раствор, например серной кислоты) цинк растворялся даже без подключения нагрузки (элемент работал в холостую).
В начале 30-х годов 19 века англичане Кемп и Уильям Стёрджен обнаружили, что цинковый электрод покрытый амальгамой цинка (соединение цинка с ртутью), работает как и обычный цинк но не реагирует с кислотой когда электроцепь разомкнута. Это было большим достижением. Важно отметить, что также как в 18 века почти каждый любознательный человек сооружал электрические машины, чтобы трением добывать таинственное электричество, теперь каждый исследователь считал личным долгом дать человечеству новый гальванический элемент.
Английский ученый и изобретатель Джон Даниель опубликовал в 1836 г. сообщение о том, что им создан стабильный медно-цинковый элемент. В то же самое время талантливый физик и электротехник Борис Семенович Якоби изобрел гальванический элемент новой конструкции. Еще в 1834 г. Якоби, работая архитектором в Кенигсберге, собрал первый электродвигатель "вращательного действия". Для него Якоби хотел создать устойчивый источник энергии и спустя два года нашел прекрасное решение. Об этом он сообщал в феврале 1837 г. в письме к Э.X. Ленцу; письмо потом было зачитано на заседании Петербургской Академии наук. Даниель предположил, что причиной нестабильности и неэкономичности источника тока с опущенными в раствор серной кислоты цинковым и медным электродами является выделение водорода на медном электроде, и поместил этот электрод в раствор медного купороса. А цинковый так и оставался в серной кислоте. Растворы он разделил пористой перегородкой. Якоби также отметил, что "выделение водорода у медного электрода не только бесполезно, но и вредно", а цинк растворяется в кислоте, даже когда элемент не работает. Желание избежать всех этих неудобств привело Якоби к мысли о применении в элементе двух электролитов: у медного электрода - раствора сульфата меди, у цинкового - сульфата цинка. Самое главное, что преследовал и чего достиг Якоби, это то, что в процессе работы батареи изменялось только количество реагирующих веществ, но вид реакции не менялся. Это стало основным принципом при конструировании гальванических элементов для практики. Оба, Даниель и Якоби, исходили из одного и того же, оба приняли серьезные меры к устранению главной помехи, но Якоби поступил решительнее своего английского собрата. Новый стабильно работающий электрохимический источник тока получил впоследствии название элемента Даниеля-Якоби. Это был сосуд, разделенный пористой перегородкой. В одном отделении медный электрод находился в растворе медного купороса, в другом цинковый - в растворе сульфата цинка. Сульфат цинка не взаимодействует с цинком, а сульфат меди - с медью. При замыкании цепи элемента электрический ток шел от цинкового электрода к медному. Через некоторое время медный электрод делался тяжелее, а цинковый - легче. Атом цинка отдавал иону меди свои заряды и переходил в раствор в виде иона, а ион меди, получив заряды, превращался в металлическую медь. Элемент Даниеля-Якоби давал постоянное напряжение - почти ровно один вольт. Поэтому он нашел широкое применение в практике электрохимических исследований. Русский электрохимик А.С. Савельев, работавший вместе с Ленцем, сказал, что это изобретение "надобно поставить в ряду самых важных открытий в области гальванизма". Работа элемента Даниеля-Якоби показала, что энергетическим источником действия вольтова столба являются химические процессы. Подтвердилась мысль, ранее высказанная Риттером, Дэви, Берцелиусом, Петровым, Фарадеем, что гальванический процесс - это процесс химический. Но окончательным этот вывод мог стать лишь после того, как был открыт и утвердился в науке закон сохранения энергии. Но у этого химического источника были другие недостатки. У него была пониженная электродвижущая сила.
Англичанин Уильям Грове заменил азотной кислотой медный купорос. А чтобы кислота не разъедала электрод, поставил вместо медного электрода платиновый. В итоге электродвижущая сила увеличилась. К сожалению, увеличилась и цена источника тока. Изготавливали платиновые электроды из очень тонких листков, согнутых буквой S для прочности. Несмотря на дороговизну, гальванические элементы Грове получили широкое распространение во многих стран.
В наше время может показаться странным, что никто не догадался использовать вместо платины уголь. Теоретическая возможность этой замены уже была известна. Но необходимо учитывать уровень технологии начала 19 века. Ещё не умели изготовлять плотных углей, а древесный уголь очень пористый. Только через несколько лет немецкий химик Роберт Бунзен придумал метод изготовления угольных стержней прессованием молотого графита, получаемого в процессе сгорания светильного газа, и угольные стержни заменили платину. Хотя, элемент Бунзена испускал значительное количество паров азотной кислоты, его охотно приняли и лаборатории, и различные предприятия.
Изобретатели трудились вовсю. В научных журналах постоянно публиковались описания и схемы все новых и новых химических источников тока. Как уже упоминалось выше, свой гальванический элемент пытался создать почти каждый, кто знал, что это такое. Например, даже французский император Наполеон III, дал миру две конструкции гальванических элементов. Во второй половине 19 века гальванические элементы начали делать в особых мастерских. Основным потребителем химических источников тока был телеграф, и его требованиями были: низкая цена, простота устройства, надежность и устойчивость в работе. При этом соглашаясь на очень маленькие токи.

Гальванические элементы Лекланше и Даниэля

Гальванические элементы Грове, Калло и Бунзена

Грене и Флейшера и сухой элемент фирмы "Сименс и Гальске"
Из множества изобретателей, самого большого успеха достиг французский химика Жоржа Лекланше. Он заполнил глиняную емкость смесью из перекиси марганца и кусочков угля из газовых реторт и вставил туда угольную призму прямоугольной формы, которая служила положительным электродом. Сверху емкость заливалась варом либо смолой и помещалась в стеклянную банку, наполненную раствором нашатыря (хлористого аммония), с электродом из цинка. При работе элемента, цинк переходил в раствор образуя хлорид цинка, а аммоний распадался на растворяющийся аммиак и водород, перекись марганца окисляет водород. Но выделение водорода зависит от силы тока, а перекись марганца окисляет водород медленно. Не поглощенный водород поляризует электрод, элемент как бы устает и ему требуется отдых. Поэтому элемент Лекланше подходит для нагрузки с маленьким током, то есть как раз для телеграфов и систем сигнализации того времени, где небольшие токи и есть перерывы в работе. Неудобство при использовании источников тока Лекланше создавал жидкостью, особенно на океанских лайнерах подвергавшихся качке, оснащенных системами сигнализаций как в первоклассных отелях того времени. Чтобы ликвидировать это неудобство, емкости с электролитом заполняли опилками, сверху полностью заливали тем же варом. Но из-за герметичности получившегося элемента, в нем могло слишком сильно увеличится давление газа, и они взрывались. Однако, элемент Лекланше постоянно совершенствовался, и в последствии многочисленных улучшений приобрел вид всем знакомых батареек.
В ходе использования и исследований химических источников тока, было сделано важное открытие возможности соединять гальванические элементы последовательно и параллельно. При последовательном соединении получалось суммарное напряжение, а при параллельном получали суммарный ток. Для того времени это было серьезное открытие.
Слово "аккумулятор" происходит от латинского accumulator, что означает "собиратель". В технике так называют устройства, накапливающие энергию с целью ее дальнейшего применения. При этом аккумулятор может быть не только электрическим. Наиболее простым видом аккумулятора можно считать сжатую или растянутую пружину, в которой накапливается механическая энергия, или тяжелый маховик, раскрученный до большого числа оборотов и запасающий таким образом кинетическую энергию. На гидроаккумулирующих станциях излишек электроэнергии используется для подъема воды из нижнего резервуара в верхний. Существуют пневматические аккумуляторы, тепловые и, наконец, электрические.
Давайте еще раз возвратимся ко времени, когда Александро Вольта создал свою первую батарею. Для большинства это было чудо, которое привлекло еще больше любителей физики к электрическим опытам. Год или два спустя учитель музыки в Париже, некто Готеро, проводящий эксперимент по разложению воды на кислород и водород с помощью вольтова столба, заметил, что две золотые проволочки нехитрого прибора, соединенные вместе по окончании эксперимента и приложенные к языку, дают такое же ощущение, как и батарея Вольты, только значительно слабее. Истолковать это незначительное явление никто не мог, да оно было и не очень-то впечатляющим. Но несколько лет спустя к его опыту вернулся немецкий фармацевт Иоганн Вильгельм Риттер, ставший позднее за смелость мысли и широту взглядов членом Мюнхенской академии. Он соорудил столбик из сорока только медных кружков, проложенных суконками, которые были смочены подкисленной водой. Соединил полюса столбика с вольтовой батареей и через некоторое время убедился, что его конструкция зарядилась электричеством. Теперь вторичные, или заряжаемые, столбы привлекли к себе внимание многих. Тем более что существующие гальванические элементы очень быстро утрачивали свою силу из-за поляризации. В 1839 году Грове изобрел газовый вторичный элемент, который давал ток только после зарядки его от какого-нибудь постороннего источника.
Газовый элемент Грове состоит из платиновых электродов, при заряде, над одним скапливается водород над другим кислород. Электролитом служит серная кислота. При разряде протекает обратная реакция окисления водорода и восстановления кислорода. Напряжение составляет около 1В. Этот элемент является прототипом топливных элементов. Но из-за неудобства пользования, газовый элемент Грове распространения не получил. (Существует и другой элемент с именем Грове, и желательно их не путать)

Рис.1. Газовый элемент Грове
Примерно в 1859-1860 годах в лаборатории Александра Беккереля - второго представителя славной династии французских физиков - работал в качестве ассистента Гастон Планте. Молодой человек решил заняться улучшением вторичных элементов, чтобы сделать их надежными источниками тока для телеграфии. Сначала он заменил платиновые электроды "газового элемента" Грове свинцовыми. А после многочисленных экспериментов и поисков вообще перешел к двум тонким свинцовым пластинкам. Он их проложил суконкой и навил этот сэндвич на деревянную палочку, чтобы он влезал в круглую стеклянную банку с электролитом. Далее подключил обе пластины к батарее. Через некоторое время вторичный элемент зарядился и сам оказался способен давать достаточно ощутимый постоянной ток. При этом, если его сразу не разряжали, способность сохранять электродвижущую силу оставалась в нем на довольно продолжительное время. Это было настоящее рождение накопителя электрической энергии, или аккумулятора.
Рис.2. Один из первых аккумуляторов
Первые электрические аккумуляторы Гастона Планте имели небольшую емкость, то есть запасали совсем мало электричества. Но соединив несколько банок последовательно, напряжение батареи можно было повысить, а при параллельном их включении повышалась емкость. При этом ток прибора оказывался тем сильнее, чем большая поверхность пластин соприкасалась с раствором электролита.
Потом было обнаружено, что если заряженный первоначально прибор разрядить, затем пропустить через него ток в обратном направлении, да еще проделать эту операцию не один раз, то увеличивается слой окисла на электродах и емкость вторичного элемента возрастает. Этот процесс получил название формовки пластин и занимал у изобретателя Камилла Фора около трех месяцев.
Камилл Фор с юных лет увлекался техникой. Но он был беден и не получил образования. Вынужденный зарабатывать на жизнь, Камилл поменял множество специальностей. Был рабочим, чертежником, техником, химиком на английском пороховом заводе, трудился и у Планте. Разносторонние практические знания сослужили самоучке хорошую службу.
После Парижской выставки 1878 года Фору пришла идея нового метода формовки пластин. Он попробовал заранее покрывать их оксидом свинца, свинцовым суриком. При зарядке сурик на одной из пластин превращался в перекись, а на другой соответственно раскислялся. При этом слой окисла приобретал очень пористое строение, а значит, площадь его поверхности существенно увеличивалась. Процесс формовки проходил значительно быстрее. Аккумуляторы Фора при том же весе запасали значительно больше электрической энергии, чем аккумуляторы Планте. Другими словами, их энергоемкость была выше. Это обстоятельство привлекло к ним большое внимание электротехников.
В конце столетия во многих странах на улицах и в домах появилось электрическое освещение. Лампы накаливания питались энергией пока еще маломощных машин постоянного тока. Ранним утром и поздним вечером, когда энергии требовалось больше, на помощь машинам приходили аккумуляторы. Это было существенно дешевле, чем ставить дополнительные генераторы. Тем более что в дневные и ночные часы аккумуляторы могли заряжаться, накапливая излишки вырабатываемой машинами энергии.
Последующее совершенствование свинцово-кислотных аккумуляторов шло по пути улучшения их конструкции и изменения технологии производства пластин. Несмотря на широкое распространение, свинцовый аккумулятор - довольно капризное детище электротехники.
Недостатки кислотных аккумуляторов еще на заре их развития побуждали изобретателей искать замену свинцу. Попыток было немало. Большинство безуспешных. Удача выпала на долю Томаса Алвы Эдисона. После множества экспериментов американский изобретатель создал железо-никелевый щелочной аккумулятор, который широко применяется в наши дни. В нем отрицательный электрод выполнен из пористого железа или кадмия с большой рабочей поверхностью. Положительный электрод - никелевый, окруженный окисью трехвалентного никеля. В качестве электролита применяется 20%-ный раствор едкого калия или едкого натрия. Корпус чаще всего изготавливается из стали. Правда, электродвижущая сила щелочного аккумулятора немного ниже, чем у свинцового. Коэффициент полезного действия тоже меньше (примерно в два раза). Да и стоит щелочной аккумулятор дороже. Но он хорошо выдерживает перегрузки, нечувствителен к избыточному заряду и глубокому разряду, прочен, легко переносит перегрев и не нуждается в ремонте.
И сейчас во всех промышленно развитых странах внимание многих научно-исследовательских коллективов направлено на создание новых типов аккумуляторов и супераккумуляторов. Основная задача - повысить энергоемкость: повысить количество запасаемой энергии на единицу веса аккумулятора.
В наши дни количество израсходованной электроэнергии измеряет всем знакомый счётчик. Чем больше электричества пройдёт через него, тем больше оборотов сделает диск и тем выше показания счётчика. Современный прибор, как правило, отградуирован в киловатт-часах (кВт•ч). Однако первый электросчётчик, который придумал в 80-ых годах 19 в. знаменитый американский изобретатель Томас Алва Эдисон (1847-1931), был совершенно другим. В нём использовался принцип электролиза. В те времена использовался постоянный ток напряжением 110 В. У каждого потребителя своей электрической компании Эдисон поместил эбонитовую коробочку, в которую помещались две цинковые пластинки, погружённые в водный раствор сульфата цинка. При прохождении тока цинк постепенно переносился с анода на катод, в результате чего массы пластинок изменялись. Ещё Фарадей в 1833-1834 гг. установил, что при прохождении через раствор соли цинка 96 500 Кл электричества (это число называется постоянной Фарадея, её точное значение 96 484,6 Кл/моль) на катоде выделяется 32,7 г металлического цинка, т.е. ровно 0,5 моль, поскольку Zn2+ - двухзарядный ион. Поэтому по изменению массы пластинок определяли, сколько электроэнергии использовал потребитель.
Но пропускать весь ток через электрохимическую ячейку было невыгодно: она бы сильно нагревалась, а цинковый анод быстро израсходовался. Поэтому Эдисон параллельно каждой ячейке присоединил шунт - пластинку из нейзильбера (сплав меди, никеля и цинка) шириной около 6 см и толщиной 0,25 мм. Через шунт проходило 99% всего электричества, а через ячейку - только 1%. Ещё одна проблема состояла в том, что при росте температуры воздуха электропроводность раствора в ячейке увеличивается. Это выгодно компании (счётчик покажет больший расход электроэнергии, чем на самом деле), но не потребителю. Изобретательный Эдисон решил проблему просто: к каждой электрохимической ячейке он подключил катушку из медной проволоки с точно рассчитанным сопротивлением. В отличие от раствора в ячейке, сопротивление меди с повышением температуры увеличивается. Таким образом, изменение температурного режима действует на электропроводность раствора и катушки "в разные стороны"; в итоге общее сопротивление счётчика остаётся постоянным как при повышении, так и при понижении температуры. Наконец, чтобы в очень холодную погоду счётчик не утратил своих качеств, устройство включало небольшую лампочку, подогревающую ячейку.
Раз в месяц электрик обходил потребителей, вставлял заранее взвешенные новые катодные пластинки, а отработанные относил на центральную станцию. Там их промывали, сушили и взвешивали, после чего выписывали счёт за использованную электроэнергию, как это было тогда принято - по количеству израсходованных ампер-часов (1 А ч составляет 3600 А с, или 3600 Кл).
В 1888 г. у электрической компании "Бостон Эдисон" было 800 таких счётчиков электроэнергии. Их обслуживали два электрика и три "мальчика на побегушках". Сравнение количества электричества, выработанного центральной станцией, с суммой показаний всех электрохимических счётчиков, установленных у потребителей, давало расхождение не более 3%. Такая точность вполне устраивала владельцев компании.
Свинцовые аккумуляторы (Pb). Реагентами в свинцовых аккумуляторах служат диоксид свинца (PbO2) и свинец (Pb), электролитом - раствор серной кислоты. Они также называются свинцово-кислотными аккумуляторами. Их разделяют на четыре основные группы; стартерные, стационарные, тяговые и портативные (герметизированные). Наиболее распространенные из свинцовых аккумуляторов - стартерные аккумуляторы, предназначены для запуска двигателей внутреннего сгорания и энергообеспечения устройств машин. В последние годы в основном используются аккумуляторы, не требующие ухода. К недостаткам относят невысокие удельную энергию и наработку, плохую сохранность заряда, выделение водорода.
Стационарные аккумуляторы используются в энергетике, на телефонных станциях, в телекоммуникационных системах, в качестве аварийного источника тока и т.д. Обычно они работают в режиме непрерывного подзаряда. Относятся к недорогим аккумуляторам.
Тяговые аккумуляторы предназначены для электроснабжения электрокаров, подъемников, шахтных электровозов, электромобилей и других машин. Действуют в режимах глубокого разряда, имеют большой ресурс и низкую стоимость.
Портативные (герметизированные) свинцовые аккумуляторы используются для питания приборов, инструмента, аварийного освещения. К их достоинствам относятся более низкая стоимость по сравнению со стоимостью других портативных аккумулторов, широкий интервал рабочих температур. Недостатками кислотных аккумуляторов являются невозможность хранения в разряженном состоянии, трудность изготовления аккумуляторов малых размеров. Свинцово-Кислотные Аккумуляторы
Никель-кадмиевые аккумуляторы (Ni-Cd). Реагентами в никель-кадмиевых аккумуляторах служат гидроксид никеля и кадмий, электролитом - раствор КОН, поэтому они именуются щелочными аккумуляторами. Существуют три основных вида никель-кадмиевых аккумуляторов: негерметичные с ламельными (ламельные аккумуляторы) и спеченными электродами (безламельные аккумуляторы) и герметичные. Наиболее дешевые ламельные никель-кадмиевые аккумуляторы характеризуются плоской разрядной кривой, высокими ресурсом и прочностью, но не низкой удельной энергией. Удельная энергия, скорость разряда Ni-Cd аккумуляторов со спеченными электродами выше, они работоспособны при низких температурах, но дороже, характеризуются эффектом памяти и способностью к тепловому разгону.
Применяются никель-кадмиевые аккумуляторы для питания шахтных электровозов, подъемников, стационарного оборудования, средств связи и электронных приборов, для запуска дизелей и авиационных двигателей и т.п.
Герметичные Ni-Cd аккумуляторы характеризуются горизонтальной разрядной кривой, высокими скоростями разряда и способностью действовать при низких температурах, но они дороже герметизированных свинцовых аккумуляторов и характеризуются эффектом памяти. Применялись для питания портативной аппаратуры (сотовых телефонов, магнитофонов, компьютеров и т.д.), бытовых приборов, игрушек и т.д. Недостатком никель-кадмиевых аккумуляторов является применение токсичного кадмия. Ni-Cd Аккумуляторы
Никель-железные аккумуляторы. Вместо кадмия в этих аккумуляторах используется железо. Из-за выделения водорода с самого начала заряда аккумуляторы производят только в негерметичном варианте. Они дешевле никель-кадмиевых аккумуляторов, не содержат токсичный кадмий, имеют длинный срок службы и высокую механическую прочность. Однако они характеризуются высоким саморазрядом, низкой отдачей по энергии, практически неработоспособны при температуре ниже -10 °С. Выпускаются в призматическом виде и используются в основном как тяговые источники тока в шахтных электровозах, электрокарах и промышленных подъемниках.
Никель-металлогидридные аккумуляторы (Ni-MH). Активным материалом отрицательного электрода является интерметаллид, обратимо сорбирующий водород, т.е. фактически отрицательный электрод является водородным электродом, у которого восстановленная форма водорода находится в абсорбированном состоянии. Разрядная кривая Ni-MH аккумулятора аналогична кривой Ni-Cd аккумулятора. Удельная емкость и энергия никель-металлогидридных аккумуляторов в 1,5-2 раза выше удельной энергии никель-кадмиевых аккумуляторов, кроме того, они не содержат токсичный кадмий. Изготавливаются в герметичном исполнении цилиндрической, призматической и дисковой форм. Применяются для питания портативных приборов и аппаратуры. Ni-MH Аккумуляторы
Никель-цинковые аккумуляторы. Это щелочные аккумуляторы, у которых отрицательный электрод - цинковый. Удельная энергия никель-цинковых аккумуляторов примерно в 2 раза выше удельной энергии Ni-Cd аккумуляторов. Они характеризуются горизонтальной разрядной кривой, высокой удельной мощностью и относительно невысокой начальной ценой, однако ресурс их мал, поэтому массового применения не имеют. Применяются для питания портативной аппаратуры
Серебряно-цинковые и серебряно-кадмиевые аккумуляторы. Активными материалами служат оксид серебра на положительном и цинк или кадмий - на отрицательном электродах соответственно, электролитом является раствор щелочи. Характеризуются высокими удельными энергиями и мощностью, низким саморазрядом, но весьма дороги. Серебряно-цинковые аккумуляторы имеют незначительный ресурс. Выпускаются в призматической и дисковой формах, применяются для питания портативных приборов и аппаратов, в военной технике.
Никель-водородные аккумуляторы. Отрицательным электродом служит пористый газодиффузионный электрод с платиновым катализатором, на котором обратимо реагирует газообразный водород. Характеризуются высокой удельной энергией и очень высоким ресурсом, но значительным саморазрядом и очень дороги. Применялись в космической технике.
Литий-ионные аккумуляторы (Li-ion). В качестве отрицательного электрода применяется углеродистый материал, в который обратимо внедряются ионы лития. Активным материалом положительного электрода обычно служит оксид кобальта, в который также обратимо внедряются ионы лития. Электролитом является раствор соли лития в неводном апротонном растворителе. Аккумуляторы имеют высокую удельную энергию, высокий ресурс и способны работать при низких температурах. Благодаря высокой удельной энергии их производство в последние годы резко увеличилось. Выпускаются в цилиндрической и призматической формах. Они применяются в сотовых телефонах, ноутбуках и других портативных устройствах. Li-ion Аккумуляторы
Литий-полимерные аккумуляторы (Li-pol). Анодом служит углеродистый материал, в который обратимо внедряются ионы лития. Активными материалами положительных электродов являются оксиды ванадия, кобальта или марганца. Электролитом является или раствор соли лития в неводных апротонных растворителях, заключенный в микропористую полимерную матрицу, или полимер (полиакрилонитрил, полиметилметакрилат, поливинилхлорид либо другие), пластифицированный раствором соли лития в апротонном растворителе (гель-полимерный электролит). По сравнению с литий-ионными аккумуляторами литий-полимерные аккумуляторы имеют более высокие удельную энергию и ресурс и лучшую безопасность. Применяются для питания портативных электронных устройств. Li-pol Аккумуляторы
Перезаряжаемые марганцево-цинковые источники тока. Первичные цилиндрические марганцево-цинковые источники тока с щелочным электролитом определенного состава, изготовленные по специальной технологии, могут электрически перезаряжаться. Они характеризуются высокой удельной энергией, малым саморазрядом и невысокой стоимостью, выпускаются в герметичном исполнении, однако имеют очень малый ресурс (до 25-50 циклов), небольшую скорость разряда и наклонную разрядную кривую. Возможность перезаряда такого марганцево-цинкового источники тока отдельно оговаривается производителем.
Характеристики аккумуляторов
Среднее разрядное напряжение аккумуляторов находится в широком диапазоне от 1,25В у никель-кадмиевых аккумуляторов до 3,5В у литиевых аккумуляторов. С повышением скорости разряда емкость аккумуляторов уменьшается (см. рисунок), причем в минимальной степени у Ni-Cd и Ni-MH аккумуляторов. Емкость также снижается при понижении температуры. Наибольшое снижение емкости при низких температурах наблюдается у никель-железных аккумуляторов и минимальное снижение - у никель-кадмиевых со спеченными электродами и у свинцовых аккумуляторов. Высокую удельную мощность можно получить от никель-кадмиевых аккумуляторов, свинцовых (стартерных и герметизированных), никель-цинковых и серебряно-цинковых аккумуляторов. Невысокую удельную мощность имеют никель-железные аккумуляторы. Удельная массовая энергия минимальна у свинцовых аккумуляторов и максимальна у литиевых аккумуляторов. Наибольшую наработку имеют никель-водородные аккумуляторы, низким ресурсом характеризуются серебряно-цинковые и никель-цинковые аккумуляторы. Следует отметить, что по мере циклирования уменьшаются емкость, напряжение и соответственно удельная энергия аккумуляторов, причем скорости понижения удельной энергии у разных аккумуляторов существенно различаются. В наименьшей степени снижаются емкость и энергия при циклировании Ni-Cd аккумуляторов. Наработка зависит от многих причин и прежде всего от глубины разряда. Наиболее высокая скорость саморазряда отмечается у никель-водородных и никель-железных аккумуляторов, наименьшая - у серебряно-кадмиевых и серебряно-цинковых аккумуляторов. К наиболее дешевым принадлежат свинцовые аккумуляторы, к наиболее дорогим - никель-водородные, серебряно-кадмиевые и серебряно-цинковые аккумуляторы.
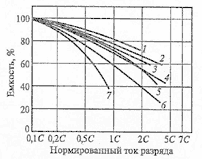
Влияние тока разряда на емкость отдаваемую аккумулятором:
1-никель-кадмиевые аккумуляторы со спеченным электродом и никель-металлгидридные аккумуляторы, 2-серебрянно-цинковые аккумуляторы, 3- никель-кадмиевые аккумуляторы с ламельным электродом, 4-никель-цинковые аккумуляторы, 5-литий-инные аккумуляторы, 6-свинцовые аккумуляторы, 7-никель-железные аккумуляторы.
Наиболее часто в мобильных устройствах (ноутбуки, мобильные телефоны, КПК и другие) применяют литий-ионные (Li-ion) аккумуляторы. Это связано с их преимуществами по сравнению с широко использовавшимися ранее никель-металлгидридными (Ni-MH) и никель-кадмиевыми (Ni-Cd) аккумуляторами.
У Li-ion аккумуляторов значительно лучшие параметры. Однако следует учитывать, что Ni-Cd аккумуляторы имеют одно важное достоинство: способность обеспечивать большие токи разряда. Это свойство не является критически важным при питании ноутбуков или сотовых телефонов (где доля Li-ion доходит до 80% и их доля становится все больше и больше), но существует достаточно много устройств, потребляющих большие токи, например всевозможные электроинструменты, электробритвы и т.п. До сих пор эти устройства являлись вотчиной почти исключительно Ni-Cd аккумуляторов. Однако в настоящее время, особенно в связи с ограничением применения кадмия в соответствии с директивой RoHS, резко активизировались исследования по созданию бескадмиевых аккумуляторов с большим разрядным током.
Первичные элементы ("батарейки") с литиевым анодом появились в начале 70-х годов 20 века и быстро нашли применение благодаря большой удельной энергии и другим достоинствам. Таким образом, было осуществлено давнее стремление создать химический источник тока с наиболее активным восстановителем - щелочным металлом, что позволило резко повысить как рабочее напряжение аккумулятора, так и его удельную энергию. Если разработка первичных элементов с литиевым анодом увенчалась сравнительно быстрым успехом и такие элементы прочно заняли свое место как источники питания портативной аппаратуры, то создание литиевых аккумуляторов натолкнулось на принципиальные трудности, преодоление которых потребовало более 20 лет.
После множества испытаний в течение 1980-х годов выяснилось, что проблема литиевых аккумуляторов закручена вокруг литиевых электродов. Точнее, вокруг активности лития: процессы, происходившие при эксплуатации, в конце концов, приводили к бурной реакция, получившей название "вентиляция с выбросом пламени". В 1991 г. на заводы-изготовители было отозвано большое количество литиевых аккумуляторных батарей, которые впервые использовали в качестве источника питания мобильных телефонов. Причина - при разговоре, когда потребляемый ток максимален, из аккумуляторной батареи происходил выброс пламени, обжигавший лицо пользователю мобильного телефона.
Из-за свойственной металлическому литию нестабильности, особенно в процессе заряда, исследования сдвинулись в область создания аккумулятора без применения Li, но с использованием его ионов. Хотя литий-ионные аккумуляторы обеспечивают незначительно меньшую энергетическую плотность, чем литиевые аккумуляторы, тем не менее Li-ion аккумуляторы безопасны при обеспечении правильных режимов заряда и разряда.
Химические процессы Li-ion аккумуляторов
Революцию в развитии перезаряжаемых литиевых аккумуляторов произвело сообщение о том, что в Японии разработаны аккумуляторы с отрицательным электродом из углеродных материалов. Углерод оказался весьма удобной матрицей для интеркаляции лития.
Для того чтобы напряжение аккумулятора было достаточно большим, японские исследователи использовали в качестве активного материала положительного электрода оксиды кобальта. Литерованный оксид кобальта имеет потенциал около 4 В относительно литиевого электрода, поэтому рабочее напряжение Li-ion аккумулятора имеет характерное значение 3 В и выше.
При разряде Li-ion аккумулятора происходят деинтеркаляция лития из углеродного материала (на отрицательном электроде) и интеркаляция лития в оксид (на положительном электроде). При заряде аккумулятора процессы идут в обратном направлении. Следовательно, во всей системе отсутствует металлический (нуль-валентный) литий, а процессы разряда и заряда сводятся к переносу ионов лития с одного электрода на другой. Поэтому такие аккумуляторы получили название "литий-ионных", или аккумуляторов типа кресла-качалки.
Процессы на отрицательном электроде Li-ion аккумулятора. Во всех Li-ion аккумуляторах, доведенных до коммерциализации, отрицательный электрод изготавливается из углеродных материалов. Интеркаляция лития в углеродные материалы представляет собой сложный процесс, механизм и кинетика которого в существенной степени зависят от природы углеродного материала и природы электролита.
Углеродная матрица, применяемая в качестве анода, может иметь упорядоченную слоистую структуру, как у природного или синтетического графита, неупорядоченную аморфную или частично упорядоченную (кокс, пиролизный или мезофазный углерод, сажа и др.). Ионы лития при внедрении раздвигают слои углеродной матрицы и располагаются между ними, образуя интеркалаты разнообразных структур. Удельный объем углеродных материалов в процессе интеркаляции-деинтеркаляции ионов лития меняется незначительно.
Кроме углеродных материалов в качестве матрицы отрицательного электрода изучаются структуры на основе олова, серебра и их сплавов, сульфиды олова, фосфориды кобальта, композиты углерода с наночастицами кремния.
Процессы на положительном электроде Li-ion аккумулятора. Если в первичных литиевых элементах применяются разнообразные активные материалы для положительного электрода, то в литиевых аккумуляторах выбор материала положительного электрода ограничен. Положительные электроды литий-ионных аккумуляторов создаются исключительно из литированных оксидов кобальта или никеля и из литий-марганцевых шпинелей.
В настоящее время в качестве катодных материалов все чаще применяются материалы на основе смешанных оксидов или фосфатов. Показано, что с катодами из смешанных оксидов достигаются наилучшие характеристики аккумулятора. Осваиваются и технологии покрытий поверхности катодов тонкодисперсными оксидами.
При заряде Li-ion аккумулятора происходят реакции:
на положительных пластинах:
LiCoO2 > Li1-xCoO2 + xLi+ + xe-
на отрицательных пластинах:
С + xLi+ + xe- > CLix
При разряде происходят обратные реакции. Процесс заряда демонстрируется рисунком.
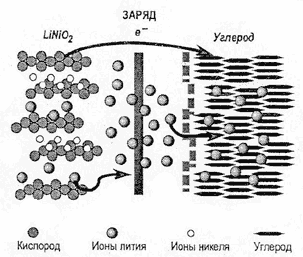
Рис.1. Процесс заряда литий-ионного (Li-ion) аккумулятора
Конструкция Li-ion аккумуляторов
Конструктивно Li-ion аккумуляторы, как и щелочные (Ni-Cd, Ni-MH), производятся в цилиндрическом и призматическом вариантах. В цилиндрических аккумуляторах свернутый в виде рулона пакет электродов и сепаратора помешен в стальной или алюминиевый корпус, с которым соединен отрицательный электрод. Положительный полюс аккумулятора выведен через изолятор на крышку (рис. 2). Призматические аккумуляторы производятся складыванием прямоугольных пластин друг на друга. Призматические аккумуляторы обеспечивают более плотную упаковку в аккумуляторной батарее, но в них труднее, чем в цилиндрических, поддерживать сжимающие усилия на электроды. В некоторых призматических аккумуляторах применяется рулонная сборка пакета электродов, который скручивается в эллиптическую спираль (рис. 3). Это позволяет объединить достоинства двух описанных выше модификаций конструкции.
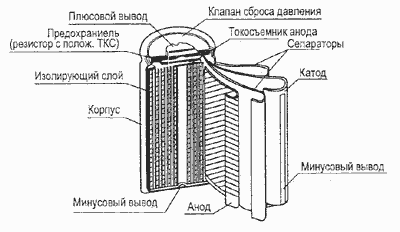
Рис.2. Устройство литий-ионного (Li-ion) аккумулятора
Рис.3. Устройство призматического литий-ионного (Li-ion) аккумулятора с рулонной скруткой электродов
Некоторые конструктивные меры обычно предпринимаются и для предупреждения быстрого разогрева и обеспечения безопасности работы Li-ion аккумуляторов. Под крышкой аккумулятора имеется устройство, реагирующее на положительный температурный коэффициент увеличением сопротивления, и другое, которое разрывает электрическую связь между катодом и положительной клеммой при повышении давления газов внутри аккумулятора выше допустимого предела.
Для повышения безопасности эксплуатации Li-ion аккумуляторов в составе батареи обязательно применяется также и внешняя электронная защита, цель которой не допустить возможность перезаряда и переразряда каждого аккумулятора, короткого замыкания и чрезмерного разогрева.
Большинство Li-ion аккумуляторов изготавливают в призматических вариантах, поскольку основное назначение Li-ion аккумуляторов - обеспечение работы сотовых телефонов и ноутбуков. Как правило, конструкции призматических аккумуляторов не унифицированы и большинство фирм-производителей сотовых телефонов, ноутбуков и т.д.. не допускают применение в устройствах аккумуляторов посторонних фирм.
Разноименные электроды в литиевых и литий-ионных аккумуляторах разделяются сепаратором из пористого полипропилена.
Конструкция Li-ion и других литиевых аккумуляторов, как и конструкция всех первичных источников тока ("батареек") с литиевым анодом, отличается абсолютной герметичностью. Требование абсолютной герметичности определяется как недопустимостью вытекания жидкого электролита (отрицательно действующего на аппаратуру), так и недопустимостью попадания в аккумулятор кислорода и паров воды из окружающей среды. Кислород и пары воды реагируют с материалами электродов и электролита и полностью выводят аккумулятор из строя.
Технологические операции производства электродов и других деталей, а также сборку аккумуляторов проводят в особых сухих комнатах или в герметичных боксах в атмосфере чистого аргона. При сборке аккумуляторов применяют сложные современные технологии сварки, сложные конструкции гермовыводов и т.д.
Закладка активных масс электродов является компромиссом между желанием достичь максимума разрядной емкости аккумулятора и требованием гарантировать безопасность его работы, которая обеспечивается при соотношении С-/С+ => 1,1 для предупреждения образования металлического лития (и тем самым возможности возгорания).
Характеристики Li-ion аккумуляторов
Современные Li-ion аккумуляторы имеют высокие удельные характеристики: 100-180 Втч/кг и 250-400 Втч/л. Рабочее напряжение - 3,5-3,7 В.
Если еще несколько лет назад разработчики считали достижимой емкость Li-ion аккумуляторов не выше нескольких ампер-часов, то сейчас большинство причин, ограничивающих увеличение емкости, преодолено и многие производители стали выпускать аккумуляторы емкостью в сотни ампер-часов.
Современные малогабаритные аккумуляторы работоспособны при токах разряда до 2 С, мощные - до 10-20С. Интервал рабочих температур: от -20 до +60 °С. Однако многие производители уже разработали аккумуляторы, работоспособные при -40 °С. Возможно расширение температурного интервала в область более высоких температур.
Саморазряд Li-ion аккумуляторов составляет 4-6 % за первый месяц, затем - существенно меньше: за 12 месяцев аккумуляторы теряют 10-20% запасенной емкости. Потери емкости у Li-ion аккумуляторов в несколько раз меньше, чем у никель-кадмиевых аккумуляторов, как при 20 °С, так и при 40 °С. Ресурс-500-1000 циклов.
Заряд Li-ion аккумуляторов.
Li-ion аккумуляторы заряжаются в комбинированном режиме: вначале при постоянном токе (в диапазоне от 0,2 С до 1 С) до напряжения 4,1-4,2 В (в зависимости от рекомендаций производителя), далее при постоянном напряжении. Первая стадия заряда может длиться около 40 мин, вторая стадия дольше. Более быстрый заряд может быть достигнут при импульсном режиме.
В начальный период, когда только появились Li-ion аккумуляторные батареи, использующие графитовую систему, требовалось ограничение напряжения заряда из расчета 4,1 В на элемент. Хотя использование более высокого напряжения позволяет повысить энергетическую плотность, окислительные реакции, происходившие в элементах такого типа при напряжениях, превышающих порог 4,1 В, приводили к сокращению их срока службы. Со временем этот недостаток ликвидировали за счет применения химических добавок, и в настоящее время Li-ion элементы можно заряжать до напряжения 4,20 В. Допустимое отклонение напряжения составляет лишь около ±0,05 В на элемент.
Li-ion аккумуляторные батареи промышленного и военного назначения должны иметь больший срок службы, чем батареи для коммерческого использования. Поэтому для них пороговое напряжение конца заряда составляет 3,90 В на элемент. Хотя энергетическая плотность (кВтч/кг) у таких батарей ниже, повышенный срок службы при небольших размерах, малом весе и более высокая по сравнению с батареями других типов энергетическая плотность ставят Li-ion батареи вне конкуренции.
При заряде Li-ion аккумуляторных батарей током 1С время заряда составляет 2-3 ч. Li-ion батарея достигает состояния полного заряда, когда напряжение на ней становится равным напряжению отсечки, а ток при этом значительно уменьшается и составляет примерно 3% от начального тока заряда (рис. 4).
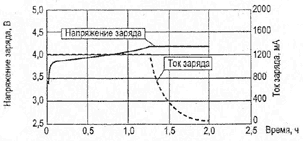
Рис.4. Зависимость напряжения и тока от времени при заряде литий-ионного (Li-ion) аккумулятора
Если на рис. 4 изображен типовой график заряда одного из типов Li-ion аккумуляторов, то на рис. 5 процесс заряда показан более наглядно. При повышении тока заряда Li-ion батареи время заряда сколько-нибудь значимо не сокращается. Хотя при более высоком токе заряда напряжение на батарее нарастает быстрее, этап подзарядки после завершения первого этапа цикла заряда продолжается дольше.
В некоторых типах зарядных устройств для заряда литий-ионной аккумуляторной батареи требуется время 1 ч и менее. В таких зарядных устройствах этап 2 исключен, и батарея переходит в состояние готовности сразу после окончания этапа 1. В этой точке Li-ion батарея будет заряжена приблизительно на 70 %, и после этого возможна дополнительная подзарядка.
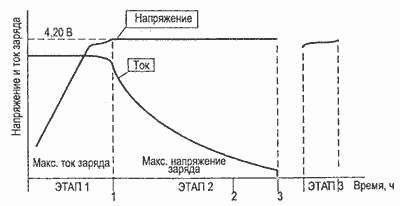
Рис.5. Зависимость напряжения и тока от времени при заряде Li-ion аккумулятора
ЭТАП 1 - Через аккумулятор протекает максимально допустимый ток заряда, пока напряжение на нем не достигнет порогового значения.
ЭТАП 2 - Максимальное напряжение на аккумуляторе достигнуто, ток заряда постепенно снижается до тех пор пока он полностью не зарядится. Момент завершения заряда наступает когда величина тока заряда снизится до значения 3% от начального.
ЭТАП 3 - Периодический компенсирующий заряд, проводящийся при хранения аккумулятора, ориентировочно через каждые 500 часов хранения.
Этап струйной подзарядки для Li-ion аккумуляторов неприменим из-за того, что они не могут поглощать энергию при перезаряде. Более того, струйная подзарядка может вызвать металлизацию лития, что делает работу аккумулятора нестабильной. Напротив, короткая подзарядка постоянным током способна компенсировать небольшой саморазряд Li-ion батареи и компенсировать потери энергии, вызванные работой ее устройства защиты. В зависимости от типа зарядного устройства и степени саморазряда Li-ion батареи такая подзарядка может выполнятся через каждые 500 ч, или 20 дней. Обычно ее следует осуществлять при снижении напряжения холостого хода до 4,05 В/элемент и прекращать, когда оно достигнет 4,20 В/элемент.
Итак, Li-ion аккумуляторы имеют низкую устойчивость к перезаряду. На отрицательном электроде на поверхности углеродной матрицы при значительном перезаряде становится возможным осаждение металлического лития (в виде мелко раздробленного мшистого осадка), обладающего большой реакционной способностью к электролиту, а на катоде начинается активное выделение кислорода. Возникает угроза теплового разгона, повышения давления и разгерметизации. Поэтому заряд Li-ion аккумуляторов можно вести только до напряжения, рекомендуемого производителем. При увеличенном зарядном напряжении ресурс аккумуляторов снижается.
Безопасной работе Li-ion аккумуляторных батарей должно уделяться серьезное внимание. В Li-ion батареях коммерческого назначения имеются специальные устройства защиты, предотвращающие превышение напряжения заряда выше определенного порогового значения. Дополнительный элемент защиты обеспечивает завершение заряда, если температура батареи достигнет 90 °С. Наиболее совершенные по конструкции батареи имеют еще один элемент защиты - механический выключатель, который срабатывает при увеличении внутрикорпусного давления батареи. Встроенная система контроля напряжения настроена на два напряжения отсечки - верхнее и нижнее .
Есть и исключения - Li-ion аккумуляторные батареи, в которых устройства защиты вообще отсутствуют. Это аккумуляторные батареи, в состав которых входит марганец. Благодаря его наличию, при перезаряде реакции металлизации анода и выделения кислорода на катоде происходят настолько медленно, что стало возможным отказаться от применения устройств защиты.
Сохранность Li-ion аккумуляторов. Все литиевые аккумуляторы характеризуются достаточно хорошей сохранностью. Потеря емкости за счет саморазряда 5-10 % в год.
Приводимые показатели следует рассматривать как некоторые номинальные ориентиры. Для каждого конкретного аккумулятора, например, разрядное напряжение зависит от тока разряда, уровня разряженности, температуры; ресурс зависит от режимов (токов) разряда и заряда, температуры, глубины разряда; диапазон рабочих температур зависит от уровня выработки ресурса, допустимых рабочих напряжений и т.д.
К недостаткам Li-ion аккумуляторов следует отнести чувствительность к перезарядам и переразрядам, из-за этого они должны иметь ограничители заряда и разряда.
Типичный вид разрядных характеристик Li-ion аккумуляторов изображен на рис. 6 и 7. Из рисунков видно, что с ростом тока разряда разрядная емкость аккумулятора снижается незначительно, но уменьшается рабочее напряжение. Такой же эффект появляется при разряде при температуре ниже 10 °С. Кроме этого, при низких температурах имеет место начальная просадка напряжения.
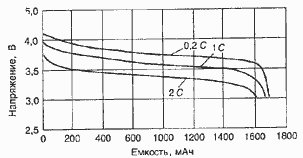
Рис.6. Разрядные характеристики Li-ion аккумулятора при различных токах
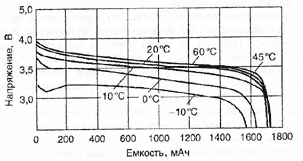
Рис.7. Разрядные характеристики Li-ion аккумулятора при различной температуре
Что касается эксплуатации Li-ion аккумуляторов вообще, то, учитывая все конструктивные и химические способы защиты аккумуляторов от перегрева и уже устоявшееся представление о необходимости внешней электронной защиты аккумуляторов от перезаряда и переразряда, можно считать проблему безопасности эксплуатации Li-ion аккумуляторов решенной. А новые катодные материалы часто обеспечивают еще большую термическую стабильность Li-ion аккумуляторов.
Безопасность Li-ion аккумуляторов. При разработке литиевых и литий-ионных аккумуляторов, как и при разработке первичных литиевых элементов, вопросам безопасности хранения и использования уделялось особое внимание. Все аккумуляторы имеют защиту от внутренних коротких замыканий (а в отдельных случаях - и от внешних коротких замыканий). Эффективным способом такой защиты является применение двухслойного сепаратора, один из слоев которого изготавливается не из полипропилена, а из материала, аналогичного полиэтилену. В случаи короткого замыкания (например, из-за прорастания дендритов лития к положительному электроду) за счет локального разогрева этот слой сепаратора подплавляется и становится непроницаемым, предотвращая, таким образом, дальнейшее прорастание дендритов.
Устройства защиты Li-ion аккумуляторных батарей
Li-ion аккумуляторные батареи коммерческого назначения имеют наиболее совершенную защиту среди всех типов батарей. Как правило в схеме защиты Li-ion батарей используется ключ на полевом транзисторе, который при достижении на элементе батареи напряжения 4,30 В открывается и тем самым прерывает процесс заряда. Кроме того, имеющийся термопредохранитель при нагреве батареи до 90 °С отсоединяет цепь ее нагрузки, обеспечивая таким образом ее термальную защиту. Но и это не все. Некоторые аккумуляторы имеют выключатель, который срабатывает при достижении порогового уровня давления внутри корпуса, равного 1034 кПа (10,5 кг/м2), и разрывает цепь нагрузки. Есть и схема защиты от глубокого разряда, которая следит за напряжением аккумуляторной батареи и разрывает цепь нагрузки, если напряжение снизится до уровня 2,5 В на элемент.
Внутреннее сопротивление схемы защиты аккумуляторной батареи мобильного телефона во включенном состоянии составляет 0,05-0,1 Ом. Конструктивно она состоит из двух ключей, соединенных последовательно. Один из них срабатывает при достижении верхнего, а другой - нижнего порога напряжения на батарее. Общее сопротивление этих ключей фактически создает удвоение ее внутреннего сопротивления, особенно если батарея состоит всего лишь из одного аккумулятора. Батареи питания мобильных телефонов должны обеспечивать большие токи нагрузки, что возможно при максимально низком внутреннем сопротивлении батареи. Таким образом, схема защиты представляет собой препятствие, ограничивающее рабочий ток Li-ion батареи.
В некоторых типах Li-ion батарей, использующих в своем химическом составе марганец и состоящих из 1-2 элементов, схема защиты не применяется. Вместо этого в них установлен всего лишь один предохранитель. И такие батареи являются безопасными из-за их малых габаритов и небольшой емкости. Кроме того, марганец довольно терпим к нарушениям правил эксплуатации Li-ion батареи. Отсутствие схемы защиты уменьшает стоимость Li-ion батареи, но привносит новые проблемы.
В частности, пользователи мобильных телефонов могут использовать для подзарядки их батарей нештатные зарядные устройства. При использовании недорогих зарядных устройств, предназначенных для подзарядки от сети или от бортовой сети автомобиля, можно быть уверенным, что при наличии в батарее схемы защиты, она отключит ее при достижении напряжения конца заряда. Если же схема защиты отсутствует, произойдет перезаряд батареи и, как следствие, ее необратимый выход из строя. Этот процесс обычно сопровождается повышенным нагревом и раздутием корпуса батареи.
Механизмы, приводящие к уменьшению емкости Li-ion аккумуляторов
При циклировании Li-ion аккумуляторов среди возможных механизмов снижения емкости наиболее часто рассматриваются следующие:
- разрушение кристаллической структуры катодного материала (особенно LiMn2O4);
- расслоение графита;
- наращивание пассивирующей пленки на обоих электродах, что приводит к снижению активной поверхности электродов и блокированию мелких пор;
- осаждение металлического лития;
- механические изменения структуры электрода в результате объемных колебаний активного материала при циклировании.
Исследователи расходятся во мнении, какой из электродов претерпевает большие изменения при циклировании. Это зависит как от природы выбранных электродных материалов, так и от их чистоты. Поэтому для Li-ion аккумуляторов удается описать только качественно изменение их электрических и эксплуатационных параметров в процессе эксплуатации.
Обычно ресурс коммерческих Li-ion аккумуляторов до понижения разрядной емкости на 20 % составляет 500-1000 циклов, но он значительно зависит от величины предельного зарядного напряжения (рисунок 8). С уменьшением глубины циклирования ресурс повышается. Наблюдаемое повышение срока службы связывают с уменьшением механических напряжений, вызываемых, изменениями объема электродов внедрения, которые зависят от степени их заряженности.
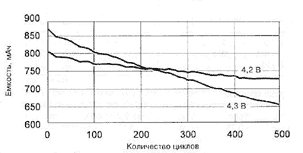
Рис.8. Изменение емкости Li-ion аккумулятора при разном предельном напряжении заряда
Повышение температуры эксплуатации (в пределах рабочего интервал) может увеличить скорость побочных процессов, затрагивающих границу раздела электрод-электролит, и несколько повысить скорость уменьшения разрядной емкости с циклами.
Заключение
В результате поисков наилучшего материала для катода современные Li-ion аккумуляторы превращаются в целое семейство химических источников тока, заметно различающихся друг от друга как энергоемкостью, так и параметрами режимов заряда/разряда. Это, в свою очередь, требует существенного увеличения интеллектуальности схем контроля, которые к настоящему времени стали неотъемлемой частью аккумуляторных батарей и питаемых устройств - в противном случае возможно повреждение (в том числе необратимое) как батарей, так и устройств. Задача усложняется еще и тем, что разработчики стараются максимально полно использовать энергию аккумуляторов, добиваясь повышения времени автономной работы при минимально занимаемом источником питания объеме и весе. Это позволяет достигнуть существенных конкурентных преимуществ. По мнению Д. Хикока, вице-президента Texas Instruments по силовым компонентам мобильных систем, при использовании катодов из новых материалов разработчики аккумуляторов далеко не сразу достигают тех же конструкционных и эксплуатационных характеристик, что и в случае с более традиционными катодами. В итоге новые аккумуляторы часто имеют значительные ограничения диапазона условий эксплуатации. Мало того, в последнее время на рынок помимо традиционных производителей аккумуляторных ячеек и батарей - Sanyo, Panasonic и Sony - очень активно пробиваются новые производители, по большей части из Китая. В отличие от традиционных производителей, они поставляют продукцию с существенно большим разбросом параметров в пределах одной технологии или даже одной партии. Это связано с их желанием конкурировать в основном за счет низкой цены продукции, что часто приводит к экономии на соблюдении требований технологического процесса.
Итак, в настоящее время существенно возрастает важность информации, предоставляемой т.н. "умными аккумуляторами": идентификация аккумулятора, температура аккумулятора, остаточный заряд и допустимое перенапряжение. По словам Хикока, если разработчики готовых устройств будут конструировать подсистему питания, учитывающую как условия эксплуатации, так и параметры ячеек, это позволит нивелировать различия в параметрах аккумуляторов и повысить степень свободы для конечных пользователей, что предоставит им возможность выбирать не только рекомендуемые производителем устройства, но и аккумуляторы других компаний.
Отметим, что изготовители аккумуляторов прилагают большие усилия к разработке катодов на основе литиевых соединений, которые позволили бы Li-ion аккумуляторам заменить Ni-Cd в устройствах с большим потребляемым током. В этой сфере представляется перспективным использование катодов на основе LiMn2O4.
Возможность замены жидкого органического электролита на полимерный, при котором должна снизиться вероятность его утечек и увеличиться безопасность работы литий-ионного аккумулятора, изучалась с самого начала коммерциализации этих источников тока.
В основе идеи литий-полимерного аккумулятора (Li-pol) лежит открытое явление перехода некоторых полимеров в полупроводниковое состояние в результате внедрения в них ионов электролита. Проводимость полимеров при этом увеличивается более чем на порядок. Усилия исследователей были направлены на поиск полимерных электролитов как для литий-ионных аккумуляторов, так и для аккумуляторов с металлическим литием, теоретически возможная плотность энергии которых в несколько раз больше, чем у литий-ионных аккумуляторов.
К настоящему времени разработаны и серийно изготавливаются литиевые источники тока с электролитами, которые могут быть подразделены на три группы:
- сухие полимерные электролиты (чаще всего на базе полиэтиленоксида, в который вводятся различные соли Li);
- гель-полимерные гомогенные электролиты, которые образуются при внедрении в полимер (или смесь полимеров) с солями Li пластификатора-растворителя;
- неводные растворы солей Li, сорбированные в микропористой полимерной матрице.
По сравнению с жидкими электролитами в литий-ионных аккумуляторах, полимерные электролиты имеют меньшую ионную проводимость, которая к тому же понижается при температуре ниже нуля. Поэтому проблема разработок Li-pol аккумуляторов состояла не только в поиске иммобилизированного электролита с достаточно высокой проводимостью, совместимого с электродными материалами, но и в расширении температурного диапазона Li-pol аккумуляторов.
Современные литий-полимерные аккумуляторы обеспечивают удельные характеристики, сравнимые с характеристиками литий-ионных аккумуляторов. Благодаря отсутствию жидкого электролита они более безопасны в использовании, чем перезаряжаемые литиевые источники тока. Li-pol аккумуляторы компактны и могут быть выполнены в любой конфигурации. Их контейнер может быть выполнен из металлизированного полимера.
Рабочие плотности тока, однако, незначительны, и электрические характеристики Li-pol аккумуляторов заметно ухудшаются при понижении температуры из-за кристаллизации полимера.
С гель-полимерным электролитом разрабатывают аккумуляторы и литий-ионные, и с металлическим анодом. Достигнутые довольно большие плотности тока и расширение температурного интервала работы позволяют использовать такие аккумуляторы для широкого круга портативной аппаратуры, сотовых телефонов, ноутбуков, цифровой фото-техники и т.д.
Аккумуляторы с гель-полимерным электролитом производят многие компании во всем мире. Электродные материалы, рецептуры электролита и технологии изготовления Li-pol аккумуляторов разных компаний значительно различаются. Их характеристики также разнообразны.
Все разработчики отмечают, что на качество Li-pol аккумуляторов и стабильность их работы сильно воздействует однородность полимера, на которую оказывают влияние как соотношение компонентов электролита, так и температура полимеризации.
Учитывая, что уже реально показаны возможности создания литий-полимерных аккумуляторов в широком диапазоне емкостей, и тот факт, что при всех стандартных тестах на безопасность использования (перезаряд, форсированный разряд, короткое замыкание, вибрация, раздавливание и протыкание гвоздем) Li-pol аккумуляторы имеют существенно более высокие показатели по сравнению с литий-ионными аккумуляторами с жидким электролитом. Перспективы серьезного расширения производства Li-pol аккумуляторов и использования их в самых разнообразных областях техники не вызывают сомнений.
С появлением элементов литий-полимерных аккумуляторных батарей толщиной всего в 1 мм перед конструкторами электонных устройств открылись новые возможности в отношении конечной формы и размеров новой аппаратуры. Были убраны многие ограничения касательно микроминиатюризации радиоэлектронных устройств.
Иногда для снижения внутреннего сопротивления Li-pol батарей, используют добавку гелиевого электролита. Большинство литий-полимерных батарей, применяемых для питания мобильных телефонов, на самом деле являются гибридными, представляющими собой нечто среднее между литий-ионными и литий-полимерными аккумуляторами, и в них используется гелиевый электролит.
Какая же разница между литий-ионными и литий-полимерными аккумуляторными батареями с гелиевым электролитом? Хотя их характеристики и близки, в литий-полимерных батареях вместо сепараторов используется твердый электролит. Добавленный в них гелиевый электролит предназначен просто для улучшения ионообменных процессов и, таким образом, для понижения внутреннего сопротивления.
Были проведены сравнительные испытания на безопасность двух типов призматических литий-ионных аккумуляторов: с жидким и гель-полимерным электролитами (см. таблицу). При этом не принималось особых мер обеспечения безопасности аккумуляторов. Аккумуляторы испытывались проколом иглой, нагревом до 200 °С, коротким замыканием и очень высоким перезарядом (до 600 %). Как следует из таблицы, безопасность литий-ионных аккумуляторов с полимерным электролитом гораздо выше безопасности аккумуляторов с жидким электролитом.
Результаты испытаний аккумуляторов на безопасность
Вид испытаний Аккумулятор с гель-полимерным электролитом Аккумулятор с житким электролитом
Прокол иглой Не было изменений Взрыв, дым, протечка электролита, повышение температуры до 250°С
Нагрев до 200°С Не было изменений Взрыв, протечка электролита
Ток короткого замыкания Не было изменений Протечка электролита, повышение температуры на 100°С
Перезаряд (600%) Вздутие Взрыв, протечка электролита, повышение температуры на 100°С
Заряд литий-полимерных аккумуляторов
Процесс заряда литий-полимерных аккумуляторных батарей подобен заряду литий-ионных аккумуляторных батарей. Литий-полимерные батареи с гелевым электролитом чаще всего классифицируют как литий-ионные, и их процессы заряда аналогичны.
В настоящее время большая часть литий-ионных аккумуляторов коммерческого назначения на самом деле представляет собой литий-полимерные аккумуляторы с гелиевым электролитом, и литий-полимерные батареи с сухим электролитом постепенно будут ими вытеснены.
Первичные элементы с литиевым (Li) анодом появились в начале 70-х годов 20-го века и быстро нашли применение благодаря высокой удельной энергии и другим достоинствам. Таким образом, было осуществлено давнее стремление создать химический источник тока с наиболее активным восстановителем - литием, что позволило резко увеличить как рабочее напряжение источника тока, так и его удельную энергию. Если разработка первичных элементов с литиевым анодом завершилась относительно быстрым успехом и такие элементы прочно заняли свое место как источники питания портативной аппаратуры, то создание Li аккумуляторов натолкнулось на принципиальные трудности, разрешение которых заняло более 20 лет.
Химия вторичных литиевых элементов с апротонными электролитами очень близка к химии первичных литиевых элементов с твердым катодом. И в тех и в других элементах при разряде протекают одни и те же процессы - анодное растворение лития на отрицательном электроде и катодное внедрение лития в кристаллическую решетку материала положительного электрода. При заряде вторичного элемента электродные процессы должны проходить в обратном направлении. Уже в конце 70-х годов были найдены материалы для положительного электрода, на которых катодное внедрение и анодная экстракция (другими словами, катодное интеркалирование и анодное деинтеркалирование) лития протекают практически обратимо.
Изучались различные катодные материалы, которые должны были циклироваться без существенного изменения своей структуры. Среди материалов со слоистой структурой более всего были изучены дисульфид титана TiS2 и селенид ниобия Nb(Se)n, а также сульфиды и диселениды ванадия, сульфиды железа и меди. Рассматривались и соединения более сложного состава, в которые предварительно вводились добавки небольших количеств различных металлов (катионов большего радиуса, чем у катиона лития). Кристаллическая структура, характерная для катодов из оксидов металлов, позволяет обеспечить наиболее высокие удельные характеристики Li аккумулятора. Обратимая работа таких электродов зависит от степени нарушения кристаллической решетки оксида при внедрении катионов Li и от электронной проводимости оксида. Необходимо, чтобы изменения объема электрода не превышали 20 %. Наилучшие результаты по циклированию в апротонных средах были получены при применении оксидов молибдена и ванадия.
Основная проблема возникла с отрицательным электродом. При его заряде, т.е. при катодном осаждении лития образуются осложнения. При катодном осаждении Li образуется свежая очень активная поверхность, на которой нарастает пассивная пленка, а так как Li осаждается в форме дендритов, то во многих случаях в зарядо-разрядных циклах пленка целиком обволакивает отдельные микрочастицы лития, предотвращая их электронный контакт с основанием. Такое явление получило название - инкапсулирование. Инкапсулирование приводит к тому, что при каждом заряде часть лития исключается из дальнейшей работы.
Процессы, протекавшие при старении и износе электродов, в конце концов, нарушали температурную стабильность химических процессов, происходивших внутри Li аккумуляторной батареи. В результате температура Li элемента достигала точки плавления лития, и происходила бурная реакция, получившая название "вентиляция с выбросом пламени". В 1991 г. на заводы-изготовители было отозвано большое число литиевых батарей, которые впервые применили в качестве источника питания мобильных телефонов. Причина - при разговоре, когда потребляемый ток максимален, из Li аккумулятора происходил выброс пламени, обжигавшего лицо пользователю мобильного телефона.
Кроме того, дендритообразование приводит к опасности коротких замыканий, и как следствие к пожаро- и взрывоопасности таких аккумуляторов. Много усилий было направлено на поиск различных способов обработки поверхности (или введения в электролит соответствующих добавок), которая мешала бы дендритообразованию при катодном осаждении лития. На этом пути были достигнуты определенные успехи, но до сих пор проблему создания обратимо действующего литиевого электрода нельзя признать решенной.
Проблемы, связанные с применением металлического Li, пытались обойти, применив в качестве отрицательного электрода подходящий литиевый сплав. Наиболее популярным был сплав лития с алюминием. На таком электроде при разряде происходит вытравливание Li из сплава, т.е. уменьшение его концентрации, а при заряде концентрация Li в сплаве возрастает. Активность лития в сплаве несколько меньше, чем в чистом металлическом литии, так что потенциал сплавного электрода несколько более положителен (приблизительно на 0,2-0,4 В). Это приводит, с одной стороны, к понижению рабочего напряжения Li аккумулятора, но, с другой стороны, к уменьшению взаимодействия сплава с электролитом, т.е. к уменьшению саморазряда. Ключевая принципиальная проблема использования литий-алюминиевых сплавов состоит в том, что при изменении состава сплава (при циклировании) очень сильно меняется удельный объем сплава. При глубоких разрядах происходит охрупчивание и осыпание электрода, поэтому это направление не получило развития. Небольшая глубина разряда приводит, безусловно, к существенному уменьшению удельных характеристик, т.е. к практической потере преимуществ аккумуляторов с литиевым электродом..
С точки зрения удельных объемов более предпочтительны сплавы лития с тяжелыми металлами (типа сплава Вуда). Такие варианты также изучались, но удельные характеристики электродов на основе сплавов тяжелых металлов оказались весьма низкими, так что и это направление считается малоперспективным.
Из-за свойственной металлическому Li нестабильности, особенно в процессе заряда, разработки сдвинулись в область создания аккумуляторной батареи без его использования, но с использованием ионов лития. Хотя литий-ионные батареи обеспечивают меньшую энергетическую плотность, чем литиевые батареи, тем не менее они безопасны при выполнении правильных режимов заряда и разряда.
Щелочные никель-кадмиевые аккумуляторы (Ni-Cd) были изобретены еще в 1899 г. Вальдмаром Юнгнером. Однако материалы для производства таких аккумуляторов стоили дороже материалов для производства аккумуляторов других типов, и поэтому в то время широкого использования они не нашли. Только в 1932 г. была разработана технология нанесения активного материала пластин путем осаждения на губчатый (пористый) покрытый никелем электрод. А в 1947 г. стали известны работы над созданием герметичных никель-кадмиевых аккумуляторов, в которых была осуществлена возможность рекомбинации газов, выделявшихся в процессе заряда, без их отвода. Конечным результатом этих разработок и стало появление герметичных никель-кадмиевых аккумуляторных батарей, используемых и в настоящее время.
Ni-Cd аккумуляторы любят быстрый заряд, медленный разряд до состояния полного разряда и подзарядку импульсами тока, в то время как батареи других типов предпочитают частичный разряд и умеренные токи нагрузки. Это тип аккумуляторов, которые способны работать в самых жестких условиях.
Для никель-кадмиевых аккумуляторов крайне необходим полный периодический разряд: если его не делать, на пластинах элементов формируются крупные кристаллы, значительно снижающие их емкость (так называемый "эффект памяти").
Преимущества Ni-Cd аккумуляторных батарей:
• возможность быстрого и простого заряда, даже после длительного хранения аккумулятора;
• большое количество циклов заряд/разряд: при правильной эксплуатации - более 1000 циклов;
• хорошая нагрузочная способность и возможность эксплуатации при низких температурах;
• продолжительные сроки хранения при любой степени заряда;
• сохранение стандартной емкости при низких температурах;
• наибольшая приспособленность для использования в жестких условиях эксплуатации;
• низкая стоимость;
Недостатки Ni-Cd аккумуляторных батарей:
• относительно низкая по сравнению с другими типами аккумуляторных батарей энергетическая плотность;
• присущий этим аккумуляторам эффект памяти и необходимость проведения периодических работ по его устранению;
• токсичность применяемых материалов, что отрицательно сказывается на экологии, и некоторые страны ограничивают использование аккумуляторов этого типа;
• относительно высокий саморазряд - после хранения неоходим цикл заряда.
Никель-металлгидридные аккумуляторы в последние десятилетия существенно потеснили никель-кадмиевые во многих областях техники. Особенно широко они применяются в автономных источниках питания портативной аппаратуры, где увеличение их удельных характеристик в 1,5-2 раза по сравнению с никель-кадмиевыми привело к улучшению потребительских свойств этой аппаратуры.
Ni-Cd и Ni-MH источники тока, однако, имеют много общего, так как именно положительный оксидно-никелевый электрод определяет как разрядную емкость аккумулятора, так и в существенной степени его свойства.
Основные электрохимические процессы Ni-Cd аккумулятора
Основной процесс, происходящий на положительном оксидно-никелевом электроде в цикле заряда-разряда аккумуляторов, описывается следующим образом:
Ni(OH)2 + OH- > NiOOH + H2O + e- (заряд)
NiOOH + H2O + e- > Ni(OH)2 + OH- (разряд)
На отрицательном кадмиевом электроде аккумулятора проходит реакция:
Cd(OH)2 + 2e- > Cd + 2OH- (заряд)
Cd + 2OH- > Cd(OH)2 + 2e- (разряд)
Общая реакция в Ni-Cd аккумуляторе имеет вид:
2Ni(OH)2 + Cd(OH)2 > 2NiOOH + Cd + 2H2O (заряд)
2NiOOH + Cd + 2H2O > 2Ni(OH)2 + Cd(OH)2 (разряд)
При перезаряде никель-кадмиевых аккумуляторов на положительном электроде идет побочный процесс выделения кислорода:
2OH- > 1/2O2 + H2O + 2e- (перезаряд)
Кислород сквозь пористый сепаратор достигает отрицательного электрода и восстанавливается на нем:
1/2O2 + Cd + H2O > Cd(OH)2 (перезаряд)
Последняя реакция воплощает в жизнь замкнутый кислородный цикл и обеспечивает стабилизацию давления в герметичном никель-кадмиевом аккумуляторе при его перезаряде. Нужно отметить, что давление в аккумуляторе определяется не только скоростями протекания указанных реакций, но, главным образом, скоростью доставки кислорода от положительного электрода к отрицательному. Так же, при перезаряде отрицательного кадмиевого электрода может иметь место реакция выделения водорода:
H2O + e- > OH- + 1/2H2
который окисляется на оксидно-никелевом электроде в соответствии с реакцией:
NiOOH + 1/2H2 > Ni(OH)2
Реакция образования водорода опасна для герметичного аккумулятора, так как она может привести к накоплению водорода из-за низкой скорости реакции его поглощения. Для того чтобы в стандартной ситуации, условий для протекания реакции выделения водорода не возникало, в герметичном аккумуляторе емкость отрицательного электрода объемно заметно превосходит емкость положительного. Поэтому емкость герметичного никель-кадмиевого аккумулятора определяется емкостью его положительного оксидно-никелевого электрода.
Механизмы электродных реакций Ni-Cd аккумулятора
Положительный электрод
Исходный гидроксид никеля может существовать в двух формах: ?- и ?-Ni(OH)2, отличающихся степенью гидратации и плотностью. В разряженном электроде могут присутствовать обе формы Ni(OH)2. При заряде ?-Ni(OH)2 переходит в ?-NiOOH (при небольших изменениях кристаллической решетки вещества). На последней стадии заряда может образовываться ?-NiOOH. Соотношение ?- и ?-фаз NiOOH зависит от условий заряда. ?-Фаза образуется при больших скоростях заряда и/или при существенных перезарядах. Ее образование приводит к коренной перестройке структуры оксидов. Плотность ?-NiOOH равна 4,15 г/см3, плотность ?-NiOOH - 3,85 г/см3, поэтому при существенном перезаряде при образовании оксидов высшей валентности объем активной массы оксидно-никелевого электрода изменяется.
Электрохимическое поведение двух форм гидроксида никеля также различное. Заряд ?-NiOOH протекает с меньшей эффективностью, а коэффициент использования по току ниже, чем у ?-NiOOH. Разрядный потенциал ?-NiOOH ниже на 50 мВ. Но при хранении его саморазряд в 2 раза медленнее.
Для обеспечения большего ресурса следует вести заряд с небольшим перезарядом до образования ?-NiOOH, который обеспечивает малые объемные изменения электрода в цикле заряда-разряда.
Отрицательный электрод
В новых герметичных никель-кадмиевых аккумуляторах емкость кадмиевого электрода обычно выше емкости оксидно-никелевого электрода на 20-70%. Поэтому потенциал кадмиевого электрода в цикле заряда-разряда аккумулятора может считаться неизменным.
Электрические характеристики никель-кадмиевого аккумулятора
Номинальное напряжение герметичных Ni-Cd аккумуляторов - 1,2 В.
Номинальный (стандартный) режим заряда никель-кадмиевого аккумулятора - током 0,1 С в течение 16 ч.
Номинальный режим разряда никель-кадмиевого аккумулятора - током 0,2 С до напряжения 1 В.
Стандартный вид разрядных характеристик герметичных цилиндрических никель-кадмиевых аккумуляторов при разных режимах показан на рисунке 1.
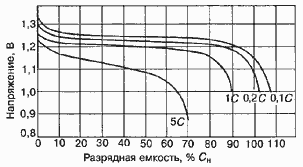
Рис.1. Разрядные характеристика никель-кадмиевого аккумулятора (Ni-Cd) при различных токах разряда
Работоспособность аккумуляторов также отображается в кривых зависимости разрядной емкости от температуры и токов нагрузки (рисунок 2 и 3).
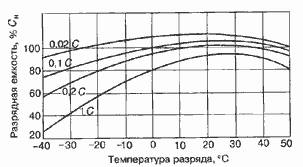
Рис.2. Разрядная характеристика никель-кадмиевого аккумулятора (Ni-Cd)< BR>
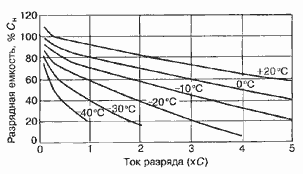
Рис.3. Разрядная характеристика никель-кадмиевого аккумулятора (Ni-Cd)
Тепловыделение в герметичном Ni-Cd аккумуляторе зависит от уровня его заряженности. После сообщения 70% емкости начинается выделение кислорода и разогрев аккумулятора, обусловленный ионизацией кислорода на отрицательном электроде. К концу заряда в стандартном режиме температура аккумулятора может взрасти на 10-15 °С. При быстром заряде разогрев больше (до 40-45 °С).
Саморазряд герметичных Ni-Cd аккумуляторов определяется в первую очередь термодинамической неустойчивостью положительного оксидно-никелевого электрода. Влияние на саморазряд микроутечек между разнополярными электродами сравнительно мало в начале эксплуатации, но возрастает с наработкой.
При отключении аккумулятора с заряда, высокий потенциал поверхности заряженного оксидно-никелевого электрода постепенно снижается. Уровни заряженности поверхностных и глубинных слоев электрода выравниваются. В результате со временем скорость саморазряда понижается. Из-за различий в рецептуре и технологии скорость саморазряда и уровень стабилизации остаточной емкости у аккумуляторов разных серий даже одного производителя могут существенно различаться.
Процесс саморазряда ведет не только к утрате емкости, но и к общему снижению напряжения (на 30-50 мВ). Это связано как с постепенным выравниванием уровня заряженности поверхностных и глубинных слоев электродов, так и с частичной пассивацией их активных масс.
Типичный характер изменения потерь емкости Ni-Cd аккумуляторов изображен на рисунке 4. Хранение аккумуляторов при более низкой температуре понижает потери: обычно саморазряд при 0 °С в 2 раза меньше, чем при 20 °С. Из рисунка видно, как понижается со временем скорость саморазряда.
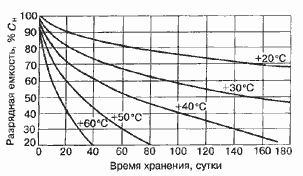
Рис.4. Саморазряд герметичного никель-кадмиевого аккумулятора при различных температурах хранения
Обычно, при потребности постоянно поддерживать максимальный уровень заряженности аккумуляторов после стандартного заряда их переключают в режим подзаряда малым током, который должен компенсировать саморазряд при хранении. Токи подзаряда (порядка 0,03-0,05 С) оговариваются производителем.
Аккумуляторы разной конструкции обладают различной способностью к продолжительному перезаряду. Понятно, что дисковые аккумуляторы с толстыми ламельными электродами менее всего способны выдержать перезаряд. Среди цилиндрических аккумуляторов есть такие серии, аккумуляторы которых способны переносить перезаряд током 0,1С в течение многих месяцев.
Удельные энергетические характеристики Ni-Cd аккумуляторов
Дисковые аккумуляторы с двумя электродами среди герметичных никель-кадмиевых аккумуляторов обладают самыми маленькими удельными энергетическими характеристиками: 15-18 Втч/кг и 35-45 Втч/л. Аккумуляторы дисковые с четырьмя электродами имеют вдвое более высокие характеристики. А удельные энергетические характеристики цилиндрических аккумуляторов достигают величин 45 Втч/кг и 130 Втч/л. У Ni-Cd аккумуляторов с положительным электродом на войлочной основе они еще выше: до 55 Втч/кг и 175 Втч/л.
Эксплуатационные характеристики Ni-Cd аккумуляторов
Режимы разряда
Разрядные характеристики аккумуляторов при разных плотностях тока определяются особенностями аккумуляторов, влияющими на величину их внутреннего сопротивления. К таким особенностям принадлежат прежде всего толщина электродов и их структурные характеристики, плотность сборки пакета электродов, толщина и структура сепаратора, количество электролита и отдельные параметры конструкции аккумулятора.
Для дисковых аккумуляторов с толстыми прессованными электродами, предназначенных для работы при продолжительном режиме разряда, характерна разрядная кривая с изменением напряжения с постоянно малой скоростью до напряжения 1,1В. Разрядная емкость, снимаемая при дальнейшем разряде до 1В, составляет 5-10 % Сн.
У этих аккумуляторов отмечается заметное снижение среднего разрядного напряжения и отдаваемой емкости с увеличением плотности тока до 0,2С. Это определяется невозможностью равномерного быстрого разряда активной массы по всей толщине электрода.
Снижение толщины электродов (при увеличении их числа с 2 до 4) позволило для дисковых аккумуляторов, предназначенных для использования при среднем режиме разряда, увеличить границу токов разряда до 0,6 С.
Короткоразрядные аккумуляторы с металлокерамичеекими электродами благодаря малому внутреннему сопротивлению обладают более высокими энергетическими показателями. При номинальных токах разряда разрядная кривая аккумуляторов имеет меньший градиент спада напряжения. Обычно, напряжение аккумуляторов выше 1,2В сохраняется вплоть до исчерпания 0,9 Сн. При разряде от 1,1 до 1,0В снимается не более 3% Сн. Такие аккумуляторы могут быть использованы при разряде токами до 3-5 С.
Современные цилиндрические Ni-Cd аккумуляторы с рулонными электродами допускают еще более высокие разрядные токи: для некоторых типов аккумуляторов максимальный долговременный ток составляет 7-10С.
Влияние режима разряда на величину разрядной емкости изображено на рисунках 2 и 3. Из рисунка видно, насколько существенным фактором внешнего влияния на электрические характеристики аккумуляторов является температура окружающей среды. Емкость, которая может быть получена от аккумулятора при 20 °С, наибольшая. Она почти не уменьшается и при разряде при более высокой температуре. Но при температуре ниже 0 °С разрядная емкость уменьшается, и тем больше, чем больше разрядный ток.
Снижение емкости при низкой температуре связано со снижением разрядного напряжения аккумулятора из-за существенного роста как омического, так и поляризационного сопротивления. Рост сопротивления определяется малым количеством электролита в герметичном аккумуляторе. Именно поэтому так существенно сказываются на характеристиках аккумулятора концентрация и состав электролита, которые определяют температуру образования в электролите той или иной твердой фазы: льда, кристаллогидратов, солей и др. Замерзание электролита вообще исключает вероятность разряда. Поэтому нижняя температурная граница работоспособности герметичных никель-кадмиевых аккумуляторов редко бывает ниже -20 °С. Но при коррекции состава и концентрации электролита в отдельных типах аккумуляторов при -40 °С удается получить - 0,5Сн при токе разряда 0,2С и 0,2Сн при токе 1С.
Режимы заряда Ni-Cd аккумуляторов
При заряде герметичного аккумулятора кроме проблемы восстановления истраченной энергии, важным является ограничение его перезаряда, поскольку процесс заряда сопровождается повышением давления внутри аккумулятора. По мере заряда оксидно-никелевого электрода начинается побочный процесс выделения кислорода, и коэффициент использования тока к окончанию заряда заметно падает. На рисунке 5 показаны типичные кривые, отображающие зависимость разрядной емкости цилиндрического аккумулятора от емкости, сообщенной при разных скоростях заряда. Из этих кривых видно, что для полного заряда аккумулятора ему достаточно сообщать не более 160 % номинальной емкости.
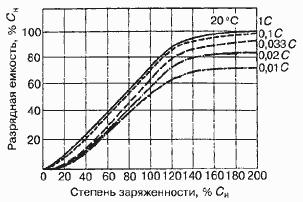
Рис.5. Эффективность заряда никель-кадмиевого аккумулятора при различной скорости заряда
Аккумуляторы могут быть заряжены при температуре от 0 до +40 °С, наиболее эффективно в интервале температур от +10 до +30 °С. При низкой температуре поглощение кислорода на отрицательном электроде сильно замедляется и при перезаряде быстрое повышение давления может привести к открытию аварийного клапана. При высокой температуре понижается потенциал, при котором на положительном электроде начинает выделяться кислород, что приводит к более раннему началу этого процесса.
При одной и той же температуре повышение тока для ускорения процесса заряда приводит к увеличению скорости выделения кислорода. Скорость газо-поглощения кислорода при этом практически не изменяется. Она в большей степени зависит от особенностей аккумулятора, которые определяют перенос кислорода от положительного электрода к отрицательному, а именно: от плотности компоновки пакета электродов, толщины и структурных параметров электродов и сепарационного материала, количества электролита.
Заряд тем эффективнее, чем тоньше электроды аккумулятора и плотнее сборка их пакета. Именно поэтому цилиндрические аккумуляторы с электродами рулонного типа больше приспособлены к заряду с большой скоростью. Из кривых на рисунке 5 видно, что для таких аккумуляторов эффективность заряда в интервале токов заряда 0,1-1С практически не изменяется. А уменьшение тока заряда приводит к заметному уменьшению емкости, которую можно получить от аккумулятора при последующем разряде.
Номинальным (стандартным) режимом заряда является режим, при котором аккумулятор, разряженный до 1В, заряжается током 0,1С в течение 16 ч. Для отдельных аккумуляторов продолжительность заряда в номинальном режиме составляет 14 ч. Это ограничение оговаривает предприятие-изготовитель, оно определяется особенностями конструкции аккумулятора или повышенной закладкой активных масс с целью увеличения емкости.
Кроме гальваностатического заряда (заряда при постоянном токе) для герметичных никель-кадмиевых аккумуляторов могут быть применены другие стратегии заряда, при которых в конце зарядного процесса ток снижается плавно или ступенчато до величин, позволяющих вести процесс практически бесконечно без повреждения аккумулятора. В этом случае на начальной ступени заряда ток может быть значительно выше стандартного тока 0,1 С.
В настоящее время во многих случаях появляется настоятельная необходимость в ускорении процесса заряда. Эта проблема решается при применении аккумуляторов, способных к эффективному заряду током повышенной плотности, постоянным по величине в процессе всего заряда, и систем контроля, не допускающих чрезмерного перезаряда аккумуляторов.
Большая часть цилиндрических аккумуляторов может быть заряжена постоянным током 0,2 С за 6-7 ч либо током 0,3 С за 3-4 ч (при контроле лишь времени заряда). При ускоренном относительно стандартного заряде рекомендуется перезаряд не более чем до 120-140 %. При этом обеспечивается разрядная емкость не менее номинальной. Аккумуляторы серий, разработанных для циклирования в ускоренных режимах, могут быть заряжены еще быстрее: в течение около 1 ч. Но в этом случае они требуют специфического контроля напряжения и/или температуры во избежание деградации аккумуляторов из-за быстрого увеличения давления.
Пауза между зарядом и разрядом
После прекращения заряда повышение давления в аккумуляторе некоторое время продолжается, так как на оксидно-никелевом электроде идет процесс окисления гидроксильных ионов. По мере снижения потенциала оксидно-никелевого электрода за счет саморазряда скорость процесса газовыделения понижается и становится соизмеримой со скоростью поглощения кислорода на отрицательном электроде. В результате давление в аккумуляторе начинает понижаться. Понятно, что при одинаковом уровне перезаряда чем больше была скорость заряда, тем больше растет давление в аккумуляторе после прекращения заряда.
Изменения в никель-кадмиевом аккумуляторе в процессе эксплуатации
Работоспособность герметичных никель-кадмиевых аккумуляторов при эксплуатации определяется главным образом постепенными изменениями, которые происходят в аккумуляторах при циклировании и приводят к неминуемому уменьшению разрядной емкости и напряжения.
Анализ данных об отказах герметичных никель-кадмиевых аккумуляторов показывает, что при их эксплуатации накапливаются эффекты, связанные со следующими факторами:
- потерей активных масс и перераспределением их на электродах;
- понижением рабочей поверхности электродов;
- протеканием процессов, связанных с необратимым потреблением кислорода и воды, а также распадом органических веществ (различных добавок);
- изменением количества и состава электролита и его перераспределением внутри аккумулятора;
- появлением утечек по проводникам 1-го рода в результате роста дендритов металлического кадмия.
Изменения в оксидно-никелевом электроде
В результате циклического изменения плотности активных масс оксидно-никелевого электрода при длительном циклировании аккумуляторов имеет место набухание положительного электрода и снижается его механическая прочность. Ухудшение контакта между основой оксидно-никелевого электрода и активной массой приводит к уменьшению электрической проводимости электрода и снижению емкости аккумулятора.
Снижение механической прочности оксидно-никелевого электрода происходит в большей степени при регулярных перезарядах, что связано с эффектами от процесса выделения кислорода в поровом пространстве оксидно-никелевого электрода. При этом в спеченных металлокерамических электродах эти изменения существенно меньше, чем в электродах прессованных.
При циклировании аккумулятора отмечается также укрупнение кристаллической структуры активных масс оксидно-никелевого электрода, что влечет за собой уменьшение рабочей поверхности электрода и снижение емкости аккумулятора.
Изменения в кадмиевом электроде
Главным процессом на отрицательном кадмиевом электроде, определяющим его деградацию, является процесс миграции активной массы, которая после длительного циклирования обнаруживается и в сепараторе, и на поверхности положительного электрода. Результатом этого является не только некоторая потеря активных масс, но и блокировка пор в поверхностных слоях кадмиевого электрода, которая препятствует доступу электролита в глубь его и приводит к увеличению внутреннего сопротивления аккумулятора. Миграция активных масс и прорастание дендритных мостиков от отрицательного электрода через сепаратор вплоть до поверхности оксидно-никелевого электрода приводит к микро- коротким замыканиям разнополярных электродов. В итоге саморазряд аккумуляторов увеличивается.
В кадмиевом электроде, как и в оксидно-никелевом электроде, при циклировании аккумулятора имеют место рост крупных кристаллов и некоторое набухание активных масс.
Необратимые окислительно-восстановительные процессы
В герметичном Ni-Cd аккумуляторе могут протекать также и другие необратимые процессы, ограничивающие срок службы аккумулятора. Один из этих процессов связан с высоким окислительным потенциалом оксидно-никелевого электрода, с возможностью окисления на нем органических примесей, активирующих и стабилизирующих добавок, находящихся в аккумуляторе. Кроме того, металлокерамическая основа оксидно-никелевого электрода способна при циклировании медленно окисляться с потреблением воды и образованием гидроксида никеля Ni(OH)2.
Повышение давления в герметичном аккумуляторе
При понижении емкости отрицательного электрода изменяется соотношение емкостей положительных и отрицательных электродов. В результате при перезаряде увеличивается риск начала процесса выделения водорода. Водород при низкой скорости его рекомбинации может накапливаться в аккумуляторе от цикла к циклу и создать угрозу быстрого увеличения давления (в особенности при быстрых зарядах). У аккумуляторов дисковых и призматических при постоянно повышенном давлении деформация корпуса (еще до нарушения герметичности аккумулятора) приводит к снижению плотности сборки аккумуляторов, увеличению сопротивления аккумуляторов и уменьшению разрядного напряжения.
Водород накапливается в аккумуляторе также и при регулярных переразрядах ниже 0 В. Следует учитывать также, что в аккумуляторе присутствует и азот, который попадает в него при герметизации. Парциальное давление азота в процессе циклирования немного возрастает за счет восстановления примесей нитратов, содержащихся в электролите.
Герметичные щелочные аккумуляторы оснащены аварийным клапаном для сброса излишнего давления газа. Но их эксплуатация не предусматривает неоднократного вскрытия клапана, так как это приводит к необратимой потери баланса состава химического элемента.
Изменения состава и количества электролита
При эксплуатации аккумуляторов из-за набухания электродов и изменения их пористой структуры происходит отсасывание электролита из сепаратора. Поэтому с наработкой внутреннее сопротивление аккумулятора увеличивается.
Изменяется и состав электролита. Количество карбонатов с наработкой может значительно возрасти по сравнению с изначальным состоянием. Электропроводность электролита при этом уменьшается, и характеристики аккумуляторов при разряде короткими режимами ухудшаются при всех температурах, но особенно заметно при низких.
Влияние режимов эксплуатации и температуры на скорость процессов деградации аккумуляторов при циклировании
Температура окружающей среды является одним из самых значительных факторов внешнего воздействия, определяющим длительность работоспособного состояния герметичных аккумуляторов.
На процессы старения аккумуляторов наибольшее влияние оказывает высокая температура, при которой ускоряются все химические реакции (в 2-4 раза на каждые 10 °С), в том числе и ведущие к порче аккумулятора. Влияние температуры повышается с увеличением зарядных токов из-за разогрева аккумуляторов при перезаряде.
При низких температурах относительное понижение емкости кадмиевого электрода при длительном циклировании больше, чем уменьшение емкости оксидно-никелевого электрода, что следует учитывать при работе источника тока в северных широтах. В этом случае при заряде увеличивается опасность выделения водорода.
На срок службы аккумуляторов сильное воздействие оказывает режим эксплуатации: режим и глубина разряда, режим заряда, длительность паузы между зарядом и разрядом при непрерывном циклировании, периоды эксплуатации и хранения. На рисунке 6 показано изменение величины наработки в циклах цилиндрических аккумуляторов стандартной серии в зависимости от глубины разряда.
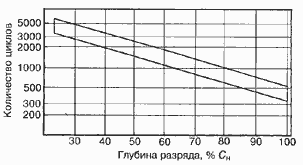
Рис.6. Наработка герметичных никель-кадмиевых аккумуляторов при разной глубине разряда
В заключение следует отметить также довольно хорошую устойчивость Ni-Cd аккумуляторов к случайным переразрядам. В этом случае в аккумуляторе выделяется водород, рекомбинация которого очень низка, но при нечастых переразрядах его количество не приводит к разгерметизации, а напряжение аккумулятора при снятии поляризации восстанавливается.
Работоспособность аккумуляторов в режиме постоянного подзаряда
В режиме непрерывного подзаряда герметичных никель-кадмиевых аккумуляторов обычно обеспечивают ток порядка 0,03-0,05 Сн. Срок эксплуатации при таком режиме зависит как от тока подзаряда, так и от температуры окружающей среды. При повышенной температуре выделение кислорода увеличивается, и это приводит к ускорению деградационных реакций в аккумуляторе.
Для работы в режиме непрерывного подзаряда при температуре в помещении до +50-55 °С многие компании разработали особые серии цилиндрических аккумуляторов с рулонным пакетом электродов, которые имеют гарантированный срок службы не менее 4 лет. В этих аккумуляторах скорректирован состав электролита и предприняты меры к ускорению процесса газопоглощения.
При первом разряде после продолжительного подзаряда емкость аккумулятора как правило несколько ниже, чем у свежезаряженных аккумуляторов, но после нескольких циклов она быстро восстанавливается до прежнего уровня.
Никель-металлогидридные (Ni-MH) аккумуляторы по своей конструкции являются аналогами никель-кадмиевых (Ni-Cd) аккумуляторов, а по электрохимическим процессам - никель-водородных аккумуляторов. Удельная энергия Ni-MH аккумулятора существенно выше удельной энергии Ni-Cd и водородных аккумуляторов.
Сравнительные характеристики щелочных аккумуляторов
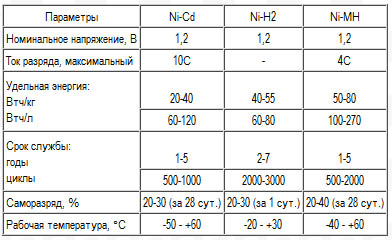
Большой разброс некоторых параметров в таблице вызван различным назначением (конструкциями) аккумуляторов.
История Ni-MH аккумулятора
Разработка никель-металлгидридных (Ni-MH) аккумуляторных батарей началась в 50-70-х гг. В результате был создан новый способ сохранения водорода в никель-водородных батареях, которые использовались в космических аппаратах.
В новом элементе водород накапливался в сплавах определенных металлов. Сплавы, абсорбирующие водород в объеме в 1000 раз больше их собственного объема, были найдены в 1960-х годах. Эти сплавы состоят из двух или нескольких металлов, один из которых абсорбирует водород, а другой является катализатором, способствующим диффузии атомов водорода в решетку металла. Количество возможных комбинаций применяемых металлов практически не ограничено, что дает возможность оптимизировать свойства сплава. Для создания Ni-MH аккумуляторов потребовалось создание сплавов, работоспособных при малом давлении водорода и комнатной температуре. В настоящее время работа по созданию новых сплавов и технологий их обработки продолжается во всем мире. Сплавы никеля с металлами редкоземельной группы могут обеспечить до 2000 циклов заряда-разряда аккумулятора при понижении емкости отрицательного электрода не более чем на 30 %.
Первый Ni-MH аккумулятор, в котором в качестве основного активного материала металлгидридного электрода применялся сплав LaNi5, был запатентован Биллом в 1975 г. В ранних экспериментах с металлгидридными сплавами, никель-металлгидридные аккумуляторы работали нестабильно, и требуемой емкости батарей достичь не получалось. Поэтому промышленное использование Ni-MH аккумуляторов началось только в середине 80-х годов после создания сплава La-Ni-Co, позволяющего электрохимически обратимо абсорбировать водород на протяжении более 100 циклов. С тех пор конструкция Ni-MH аккумуляторных батарей непрерывно совершенствовалась в сторону увеличения их энергетической плотности.
Замена отрицательного электрода позволила повысить в 1,3-2 раза закладку активных масс положительного электрода, который и определяет емкость аккумулятора. Поэтому Ni-MH аккумуляторы имеют по сравнению с Ni-Cd аккумуляторами значительно более высокими удельными энергетическими характеристиками.
Успех распространению никель-металлгидридных аккумуляторных батарей обеспечили, высокая энергетическая плотность и нетоксичностъ материалов, используемых при их производстве.
Основные процессы Ni-MH аккумуляторов
В Ni-MH аккумуляторах в качестве положительного электрода используется оксидно-никелевый электрод, как и в никель-кадмиевом аккумуляторе, а электрод из сплава никеля с редкоземельными металлами, поглощающий водород, используется вместо отрицательного кадмиевого электрода.
На положительном оксидно-никелевом электроде Ni-MH аккумулятора протекает реакция:
Ni(OH)2 + OH- > NiOOH + H2O + e- (заряд)
NiOOH + H2O + e- > Ni(OH)2 + OH- (разряд)
На отрицательном электроде металл с абсорбированным водородом превращается в металлгидрид:
M + H2O + e- > MH + OH- (заряд)
MH + OH- > M + H2O + e- (разряд)
Общая реакция в Ni-MH аккумуляторе записывается в следующем виде:
Ni(OH)2 + M > NiOOH + MH (заряд)
NiOOH + MH > Ni(OH)2 + M (разряд)
Электролит в основной токообразующей реакции не участвует.
После сообщения 70-80 % емкости и при перезаряде на оксидно-никелевом электроде начинает выделяться кислород:
2OH- > 1/2O2 + H2O + 2e- (перезаряд)
который восстанавливается на отрицательном электроде:
1/2O2 + H2O + 2e- > 2OH- (перезаряд)
Две последнии реакции обеспечивают замкнутый кислородный цикл. При восстановлении кислорода обеспечивается еще и дополнительное повышение емкости металлгидридного электрода за счет образования группы ОН-.
Конструкция электродов Ni-MH аккумуляторов
Металлводородный электрод.
Главным материалом, определяющим характеристики Ni-MH аккумулятора, является водород-абсорбирующий сплав, который может поглощать объем водорода, в 1000 раз превышающий свой собственный объем.
Самое большое распространение получили сплавы типа LaNi5, в которых часть никеля заменена марганцем, кобальтом и алюминием для увеличения стабильности и активности сплава. Для уменьшения стоимости некоторые фирмы-производители вместо лантана применяют миш-металл (Мm, который представляет собой смесь редкоземельных элементов, их соотношение в смеси близко к соотношению в природных рудах), включающий кроме лантана также церий, празеодим и неодим.
При зарядно-разрядном циклировании имеет место расширение и сжатие на 15-25% кристаллической решетки водородабсорбирующих сплавов из-за абсорбции и десорбции водорода. Такие изменения ведут к образованию трещин в сплаве из-за увеличения внутреннего напряжения. Образование трещин вызывает увеличение площади поверхности, которая подвергается коррозии при взаимодействии со щелочным электролитом. По этим причинам разрядная емкость отрицательного электрода постепенно понижается.
В аккумуляторе с ограниченным количеством электролита, это порождает проблемы, связанные с перераспределением электролита. Коррозия сплава приводит к химической пассивности поверхности из-за образования стойких к коррозии оксидов и гидроксидов, которые повышают перенапряжение основной токообразующей реакции металлогидридного электрода. Образование продуктов коррозии происходит с потреблением кислорода и водорода из раствора электролита, что, в свою очередь, вызывает снижение количества электролита в аккумуляторе и повышение его внутреннего сопротивления.
Для замедления нежелательных процессов диспергирования и коррозии сплавов, определяющих срок службы Ni-MH аккумуляторов, применяются (помимо оптимизации состава и режима производства сплава) два основных метода. Первый метод заключается в микрокапсулировании частиц сплава, т.е. в покрытии их поверхности тонким пористым слоем (5-10 %) - по массе никеля или меди. Второй метод, нашедший наиболее широкое применение в настоящее время, заключается в обработке поверхности частиц сплава в щелочных растворах с формированием защитных пленок, проницаемых для водорода.
Оксидноникелевый электрод.
Оксидно-никелевые электроды в массовом производстве изготавливаются в следующих конструктивных модификациях: ламельные, безламельные спеченные (металлокерамические) и прессованные, включая таблеточные. В последние годы начинают использоваться безламельные войлочные и пенополимерные электроды.
Ламельные электроды представляют собой набор объединенных между собой перфорированных коробочек (ламелей), произведенных из тонкой (толщиной 0,1 мм) никелированной стальной ленты.
Спеченные (металлокерамические) электроды состоят из пористой (с пористостью не менее 70%) металлокерамической основы, в порах которой располагается активная масса. Основу изготовляют из карбонильного никелевого мелкодисперсного порошка, который в смеси с карбонатом аммония или карбамидом (60-65% никеля, остальное - наполнитель) напрессовывают, накатывают или напыляют на стальную или никелевую сетку. Затем сетку с порошком подвергают термообработке в восстановительной атмосфере (обычно в атмосфере водорода) при температуре 800-960 °С, при этом карбонат аммония или карбамид разлагается и улетучивается, а никель спекается. Полученные таким образом основы имеют толщину 1-2,3 мм, пористость 80-85% и радиус пор 5-20 мкм. Основу поочередно пропитывают концентрированным раствором нитрата никеля или сульфата никеля и нагретым до 60-90 °С раствором щелочи, которая побуждает осаждение оксидов и гидроксидов никеля.
В настоящее время используется также электрохимический метод пропитки, при котором электрод подвергается катодной обработке в растворе нитрата никеля. Из-за образования водорода раствор в порах пластины подщелачивается, что приводит к осаждению оксидов и гидроксидов никеля в порах пластины.
К разновидностям спеченных электродов причисляют фольговые электроды. Электроды производят нанесением на тонкую (0,05 мм) перфорированную никелевую ленту с двух сторон, методом пульверизации, спиртовой эмульсии никелевого карбонильного порошка, содержащей связующие вещества, спеканием и дальнейшей химической или электрохимической пропиткой реагентами. Толщина электрода составляет 0,4-0,6 мм.
Прессованные электроды изготавливают методом напрессовки под давлением 35-60 МПа активной массы на сетку или стальную перфорированную ленту. Активная масса состоит из гидроксида никеля, гидроксида кобальта, графита и связующего вещества.
Металловойлочные электроды имеют высокопористую основу, сделанную из никелевых или углеродных волокон. Пористость этих основ - 95 % и более. Войлочный электрод выполнен на базе никелированного полимерного или углеграфитового фетра. Толщина электрода в зависимости от его предназначения находится в диапазоне 0,8-10 мм. Активная масса вносится в войлок разными методами в зависимости от его плотности.
Вместо войлока может использоваться пеноникель, получаемый никелированием пенополиуретана с последующим отжигом в восстановительной среде. В высокопористую среду вносятся обычно методом намазки паста, содержащая гидроксид никеля, и связующее. После этого основа с пастой сушится и вальцуется. Войлочные и пенополимерные электроды характеризуются высокой удельной емкостью и большим ресурсом.
Конструкция Ni-MH аккумуляторов.
Ni-MH аккумуляторы цилиндрической формы. Положительный и отрицательный электроды, разделенные сепаратором, свернуты в виде рулона, который вставлен в корпус и закрыт герметизирующей крышкой с прокладкой (рисунок 1). Крышка имеет предохранительный клапан, срабатывающий при давлении 2-4 МПа в случае сбоя при эксплуатации аккумулятора.
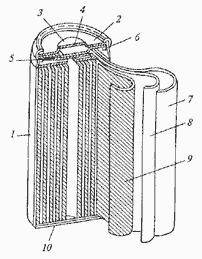
Рис.1. Конструкция никель-металлгидридного (Ni-MH) аккумулятора:
1-корпус, 2-крышка, 3-калпачок клапана, 4-клапан, 5-колектор положительного электрода, 6-изоляционное кольцо, 7-отрецательный электрод, 8-сепаротор, 9-положительный электрод, 10-изолятор.
В призматических Ni-MH аккумуляторах положительные и отрицательные электроды размещены поочередно, а между ними размещается сепаратор. Блок электродов вставлен в металлический или пластмассовый корпус и закрыт герметизирующей крышкой. На крышке как правило устанавливается клапан или датчик давления (рисунок 2).
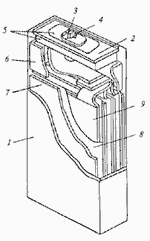
Рис.2. Конструкция Ni-MH аккумулятора:
1-корпус, 2-крышка, 3-калпачок клапана, 4-клапан, 5-изоляционная прокладка, 6-изолятор, 7-отрецательный электрод, 8-сепаротор, 9-положительный электрод.
В Ni-MH аккумуляторах используется щелочной электролит, состоящий из КОН с добавкой LiOH. В качестве сепаратора в Ni-MH аккумуляторах применяются нетканые полипропилен и полиамид толщиной 0,12-0,25 мм, обработанные смачивателем.
Положительный электрод. В Ni-MH аккумуляторах применяются положительные оксидно-никелевые электроды, аналогичные используемым в Ni-Cd аккумуляторах. В Ni-MH аккумуляторах в основном применяются металлокерамические, а в последние годы - войлочные и пенополимерные электроды (см. выше).
Отрицательный электрод. Практическое применение в Ni-MH аккумуляторах нашли пять конструкций отрицательного металлогидридного электрода (см. выше):
- ламельная, когда порошок водород-абсорбирующего сплава со связующим веществом или без связующего, запрессован в никелевую сетку;
- пеноникелевая, когда паста со сплавом и связующим веществом вводится в поры пеноникелевой основы, а потом сушится и прессуется (вальцуется);
- фольговая, когда паста со сплавом и связующим веществом наносится на перфорированную никелевую или стальную никелированную фольгу, а потом сушится и прессуется;
- вальцованная, когда порошок активной массы, состоящей из сплава и связующего вещества, наносится вальцеванием (прокаткой) на растяжную никелевую решетку или медную сетку;
- спеченная, когда порошок сплава напрессовывается на никелевую сетку и после этого спекается в атмосфере водорода.
Удельные емкости металлогидридных электродов разных конструкций близки по значению и определяются, в основном, емкостью применяемого сплава.
Характеристики Ni-MH аккумуляторов
Электрические характеристики
Напряжение разомкнутой цени. Значение напряжения разомкнутой цепи Uр.ц. Ni-MH-системы точно определить тяжело вследствие зависимости равновесного потенциала оксидно-никелевого электрода от степени окисленности никеля, а также зависимости равновесного потенциала металлогидридного электрода от степени насыщения его водородом. Через 24 часа после заряда аккумулятора, напряжение разомкнутой цепи заряженного Ni-MH аккумулятора находится в интервале 1,30-1,35 В.
Номинальное разрядное напряжение Uр при нормированном токе разряда Iр = 0,1-0,2С (С - номинальная емкость аккумулятора) при 25°С составляет 1,2-1,25В, обычное конечное напряжение - 1В. Напряжение уменьшается с ростом нагрузки (см. рисунок 3)
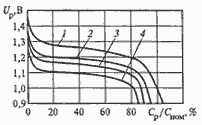
Рис.3. Разрядные характеристики Ni-MH аккумулятора при температуре 20°С и разных нормированных токах нагрузки:
1-0,2С; 2-1С; 3-2С; 4-3С
Емкость аккумуляторов. С повышением нагрузки (уменьшение времени разряда) и при понижении температуры емкость Ni-MH аккумулятора уменьшается (рисунок 4). Особенно заметно действие снижения температуры на емкость при больших скоростях разряда и при температурах ниже 0°С.
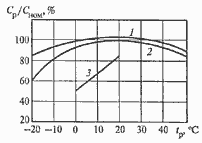
Рис.4. Зависимость разрядной емкости Ni-MH аккумулятора от температуры при разных токах разряда:
1-0,2С; 2-1С; 3-3С
Сохранность и срок службы Ni-MH аккумуляторов. При хранении происходит саморазряд Ni-MH аккумулятора. По прошествии месяца при комнатной температуре потеря емкости составляет 20-30%, а при дальнейшем хранении потери уменьшаются до 3-7% в месяц. Скорость саморазряда повышается при увеличении температуры (см. рисунок 5).
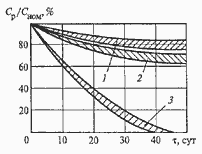
Рис.5. Зависимость разрядной емкости Ni-MH аккумулятора от времени хранения при разных температурах:
1-0°С; 2-20°С; 3-40°С
Зарядка Ni-MH аккумулятора
Наработка (число разрядно-зарядных циклов) и срок службы Ni-MH аккумулятора в значительной мере определяются условиями эксплуатации. Наработка понижается с увеличением глубины и скорости разряда. Наработка зависит от скорости заряда и способа контроля его окончания. В зависимости от типа Ni-MH аккумуляторов, режима работы и условий эксплуатации аккумуляторы обеспечивают от 500 до 1000 разрядно-зарядных циклов при глубине разряда 80% и имеют срок службы от 3 до 5 лет.
Для обеспечения надежной работы Ni-MH аккумулятора в течение гарантированного срока нужно соблюдать рекомендации и инструкцию производителя. Наибольшее внимание следует уделить температурному режиму. Желательно избегать переразрядов (ниже 1В) и коротких замыканий. Рекомендуется использовать Ni-MH аккумуляторы по назначению, избегать сочетания бывших в употреблении и неиспользованных аккумуляторов, не припаивать непосредственно к аккумулятору провода или прочие части.
Ni-MH аккумуляторы более чувствительны к перезаряду, чем Ni-Cd. Перезаряд может привести к тепловому разгону. Зарядка как правило производится током Iз=0,1С на протяжении 15 часов. Компенсационный подзаряд производят током Iз=0,01-0,03С на протяжении 30 часов и более.
Ускоренный (за 4 - 5 часов) и быстрый (за 1 час) заряды возможны для Ni-MH аккумуляторов, имеющих высокоактивные электроды. При таких зарядах процесс контролируется по изменению температуры ?Т и напряжения ?U и другим параметрам. Быстрый заряд применяется, например, для Ni-MH аккумуляторов, питающих ноутбуки, сотовые телефоны, электрические инструменты, хотя в ноутбуках и сотовых телефонах сейчас в основном используются литий-ионные и литий-полимерные аккумуляторы. Рекомендуется также трехступенчатый способ заряда: первый этап быстрого заряда (1С и выше), заряд со скоростью 0,1С в течение 0,5-1 ч для заключительной подзарядки, и заряд со скоростью 0,05-0,02С в качестве компенсационного подзаряда. Информация о способах заряда Ni-MH аккумуляторов обычно содержится в инструкциях фирмы-производителя, а рекомендуемый ток зарядки указан на корпусе аккумулятора.
Зарядное напряжение Uз при Iз=0,3-1С лежит в интервале 1,4-1,5В. По причине выделения кислорода на положительном электроде, количество электричества преданного при заряде (Qз) больше разрядной емкости (Ср). При этом отдача по емкости (100 Ср/Qз) составляет 75-80% и 85-90% соответственно для дисковых и цилиндрических Ni-MH аккумуляторов.
Контроль заряда и разряда. Для исключения перезаряда Ni-MH аккумуляторных батарей могут применятся следующие методы контроля заряда с соответствующими датчиками, устанавливаемыми в аккумуляторные батареи или зарядные устройства:
- метод прекращения заряда по абсолютной температуре Тmax. Температура батареи постоянно контролируется во время процесса заряда, а при достижении максимального значения быстрый заряд прерывается;
- метод прекращения заряда по скорости изменения температуры ?T/?t. При применении этого метода крутизна температурной кривой аккумуляторной батареи постоянно контролируется во время процесса заряда, а когда этот параметр становится выше определенно установленного значения, заряд прерывается;
- метод прекращения заряда по отрицательной дельте напряжения -?U. В конце заряда аккумулятора при осуществлении кислородного цикла начинает повышаться его температура, приводя к уменьшению напряжения;
- метод прекращения заряда по максимальному времени заряда t;
- метод прекращения заряда по максимальному давлению Pmax. Используется обычно в призматических аккумуляторах больших размеров и емкости. Уровень допустимого давления в призматическом аккумуляторе зависит от его конструкции и лежит в интервале 0,05-0,8 МПа;
- метод прекращения заряда по максимальному напряжению Umax. Применяется для отключения заряда аккумуляторов с высоким внутренним сопротивлением, которое появляется в конце срока службы из-за недостатка электролита или при пониженной температуре.
При применении метода Тmax аккумуляторная батарея может быть слишком перезаряжена, если температура окружающей среды понижается, либо батарея может получить недостаточно заряда, если температура окружающей среды значительно повышается. Метод ?T/?t может применяться очень эффективно для прекращения заряда при низких температурах окружающей среды. Но если при более высоких температурах применять только этот метод, то аккумуляторы внутри аккумуляторных батарей будут подвергаться нагреванию до нежелательно высоких температур до того, как может быть достигнуто значение ?T/?t для отключения. Для определенного значения ?T/?t может быть получена большая входная емкость при более низкой температуре окружающей среды, чем при более высокой температуре. В начале заряда аккумуляторной батареи (как и в конце заряда) происходит быстрое повышение температуры, что может привести к преждевременному отключению заряда при применении метода ?T/?t. Для исключения этого разработчики зарядных устройств используют таймеры начальной задержки срабатывания датчика при методе ?T/?t.
Метод -?U является эффективным для прекращения заряда при низких температурах окружающей среды, а не при повышенных температурах. В этом смысле метод похож на метод ?T/?t. Для обеспечения прекращения заряда в тех случаях, когда непредвиденные обстоятельства препятствуют нормальному прерыванию заряда, рекомендуется также использовать контроль по таймеру, регулирующему длительность операции заряда (метод t).
Таким образом, для быстрого заряда аккумуляторных батарей нормированными токами 0,5-1С при температурах 0-50 °С целесообразно применять одновременно методы Тmax (с температурой отключения 50-60 °С в зависимости от конструкции аккумуляторов и батарей), -?U (5-15 мВ на аккумулятор), t (обычно для получения 120 % номинальной емкости) и Umax (1,6-1,8 В на аккумулятор). Вместо метода -?U может использоваться метод ?T/?t (1-2 °С/мин) с таймером начальной задержки (5-10 мин). Про контроль заряда так же см. соответствуюшую статью
После проведения быстрого заряда аккумуляторной батареи, в зарядных устройствах предусматривают переключение их на подзаряд нормированным током 0,1С - 0,2С в течение определенного времени.
Для Ni-MH аккумуляторов не рекомендуется заряд при постоянном напряжении, так как может произойти "тепловой выход из строя" аккумуляторов. Это связано с тем, что в конце заряда происходит повышение тока, который пропорционален разности между напряжением электропитания и напряжением аккумулятора, а напряжение аккумулятора в конце заряда понижается из-за повышения температуры.
При низких температурах скорость заряда должна быть уменьшена. В противном случае кислород не успеет рекомбинироваться, что приведет к росту давления в аккумуляторе. Для эксплуатации в таких условиях рекомендуются Ni-MH аккумуляторы с высокопористыми электродами.
Достоинства и недостатки Ni-MH аккумуляторов
Значительное увеличение удельных энергетических параметров не единственное достоинство Ni-MH аккумуляторов перед Ni-Cd аккумуляторами. Отказ от кадмия означает также переход к более экологически чистым производствам. Легче решается и проблема утилизации вышедших из строя аккумуляторов. Эти достоинства Ni-MH аккумуляторов определили более быстрый рост объемов их производства у всех ведущих мировых аккумуляторных компаний по сравнению с Ni-Cd аккумуляторами.
У Ni-MH аккумуляторов нет "эффекта памяти", свойственного Ni-Cd аккумуляторам из-за образования никелата в отрицательном кадмиевом электроде. Однако эффекты, связанные с перезарядом оксидно-никелевого электрода, сохраняются.
Уменьшение разрядного напряжения, наблюдаемое при частых и долгих перезарядах так же, как и у Ni-Cd аккумуляторов, может быть устранено при периодическом осуществлении нескольких разрядов до 1 В. Такие разряды достаточно проводить 1 раз в месяц.
Однако никель-металлогидридные аккумуляторы уступают никель-кадмиевым, которые они призваны заменить, по некоторым эксплуатационным характеристикам:
- Ni-MH аккумуляторы эффективно работают в более узком интервале рабочих токов, что связано с ограниченной десорбцией водорода металлгидридного электрода при очень высоких скоростях разряда;
- Ni-MH аккумуляторы имеют более узкий температурный диапазон эксплуатации: большая их часть неработоспособна при температуре ниже -10 °С и выше +40 °С, хотя в отдельных сериях аккумуляторов корректировка рецептур обеспечила расширение температурных границ;
- в течении заряда Ni-MH аккумуляторов выделяется больше теплоты, чем при заряде Ni-Cd аккумуляторов, поэтому в целях предупреждения перегрева батареи из Ni-MH аккумуляторов в процессе быстрого заряда и/или значительного перезаряда в них устанавливают термо-предохранители или термо-реле, которые располагают на стенке одного из аккумуляторов в центральной части батареи;
- Ni-MH аккумуляторы имеют повышенный саморазряд, что определяется неизбежностью реакции водорода, растворенного в электролите, с положительным оксидно-никелевым электродом (но, благодаря использованию специальных сплавов отрицательного электрода, получилось достигнуть снижения скорости саморазряда до величин, близких к показателям для Ni-Cd аккумуляторов);
- опасность перегрева при заряде одного из Ni-MH аккумуляторов батареи, а также переполюсования аккумулятора с меньшей емкостью при разряде батареи, возрастает с рассогласованием параметров аккумуляторов в результате продолжительного циклирования, поэтому создание батарей более чем из 10 аккумуляторов не рекомендуется всеми производителями;
- потери емкости отрицательного электрода, которые имеют место в Ni-MH аккумуляторе при разряде ниже 0 В, необратимы, что выдвигает более жесткие требования к подбору аккумуляторов в батарее и контролю процесса разряда, чем в случае использования Ni-Cd аккумуляторов, как правило рекомендуется разряд до 1 В/ак в батареях незначительного напряжения и до 1,1 В/ак в батарее из 7-10 аккумуляторов.
Как уже отмечалось ранее, деградация Ni-MH аккумуляторов определяется прежде всего понижением при циклировании сорбирующей способности отрицательного электрода. В цикле заряда-разряда происходит изменение объема кристаллической решетки сплава, что приводит к образованию трещин и последующей коррозии при реакции с электролитом. Образование продуктов коррозии происходит с поглощением кислорода и водорода, в результате чего уменьшается общее количество электролита и повышается внутреннее сопротивление аккумулятора.
Следует заметить, что характеристики Ni-MH аккумуляторов существенно зависят от сплава отрицательного электрода и технологии обработки сплава для повышения стабильности его состава и структуры. Это вынуждает изготовителей аккумуляторов внимательно относиться к выбору поставщиков сплава, а потребителей аккумуляторов - к выбору компании-изготовителя.
Первый работоспособный свинцово-кислотный аккумулятор был изобретен в 1859 г. французским ученым Гастоном Планте. Конструкция аккумулятора представляла собой электроды из листового свинца, разделенные сепараторами из полотна, которые были свернуты в спираль и помещены в сосуд с 10 % раствором серной кислоты. Недостатком первых свинцово-кислотных аккумуляторов была их невысокая емкость. Поначалу для ее увеличения проводили большое число циклов заряда-разряда. Для достижения существенных результатов требовалось до двух лет таких тренировок. Причина недостатка была явной - конструкция пластин. Поэтому дальнейшее совершенствование конструкции свинцово-кислотных аккумуляторов было сосредоточено на совершенствование конструкции используемых в них пластин и сепараторов.
В 1880 г. К. Фор предложил методику изготовления намазных электродов путем нанесения на пластины окислов свинца. Такая конструкция электродов позволила значительно повысить емкость аккумуляторов. А в 1881 г. Э. Фолькмар предложил применять в качестве электродов намазную решетку. В том же году ученому Селлону был выдан патент на технологию изготовления решеток из сплава свинца и сурьмы.
Первоначально практическое использование свинцово-кислотных аккумуляторов было затруднено из-за отсутствия зарядных устройств - для заряда применяли первичные элементы конструкции Бунзена. То есть химический источник тока заряжался от другого химического источника - батареи гальванических элементов. Положение кардинально поменялось с появлением недорогих генераторов постоянного тока.
Именно свинцово-кислотные батареи первыми в мире из аккумуляторных батарей нашли коммерческое применение. К 1890 году во многих промышленно развитых странах был освоен их серийный выпуск. В 1900 году немецкая фирма Varta произвела первые стартерные аккумуляторы для автомобилей.
В 70-х годах XX века были созданы необслуживаемые свинцово-кислотные аккумуляторные батареи, способные работать в любом положении. Жидкий электролит в них сменили гелиевым или адсорбированным (впитанным) сепараторами электролитом, батареи герметизировали, а для отвода газов, выделяющихся при заряде или разряде, установили клапаны. Строго говоря, абсолютная герметизация свинцово-кислотных аккумуляторов не может быть достигнута, так как нельзя обеспечить полную рекомбинацию кислорода и водорода, которые выделяются в них при заряде и хранении. Но специальными мерами выделение газов и потери воды в процессе эксплуатации удается свести к минимуму.
Были разработаны новые конструкции пластин на базе медно-кальциевых сплавов, покрытых оксидом свинца, а также на основе титановых, алюминиевых и медных решеток.
Свинцовые аккумуляторы являются наиболее распространенными среди всех существующих в настоящее время химических источников тока. Их масштабное производство определяется как относительно низкой ценой, обусловленной сравнительной не дефицитностью исходных материалов, так и разработкой разных вариантов этих аккумуляторов, отвечающих требованиям широкого круга потребителей.
Ключевые электрохимические процессы в свинцово-кислотном аккумуляторе
Активные вещества аккумулятора сосредоточены в электролите и положительных и отрицательных электродах, а совокупность этих веществ называется электрохимической системой. В свинцово-кислотных аккумуляторных батареях электролитом является раствор серной кислоты (H2SO4), активным веществом положительных пластин - двуокись свинца (PbO2), отрицательных пластин - свинец (Pb).
Основные процессы, проходящие на электродах, описывают реакции:
На отрицательном электроде:
Pb + HSO4- > PbSO4 + H+ + 2e- (разряд)
PbSO4 + H+ + 2e- > Pb + HSO4- (заряд)
На положительном электроде:
PbO2 + HSO4- + 3H+ + 2e- > PbSO4 + 2H2O (разряд)
PbSO4 + 2H2O > PbO2 + HSO4- + 3H+ + 2e- (заряд)
Суммарная реакция в свинцовом аккумуляторе имеет вид:
PbO2 + Pb + 2H2SO4 > 2PbSO4 + 2H2O (разряд)
2PbSO4 + 2H2O > PbO2 + Pb + 2H2SO4 (заряд)
Таким образом, при разряде свинцового аккумулятора на обоих электродах формируется малорастворимый сульфат свинца (двойная сульфатация) и происходит сильное разбавление серной кислоты.
Напряжение разомкнутой цепи заряженного аккумулятора равно 2,05-2,15 В, в зависимости от концентрации серной кислоты. При разряде по мере разбавления электролита напряжение разомкнутой цепи аккумулятора понижается и после полного разряда становится равным 1,95-2,03 В.
При заряде свинцово-кислотного аккумулятора, как и в других аккумуляторах с водным электролитом, имеют место побочные реакции выделения газов. Выделение водорода начинается при полном заряжении отрицательного электрода. Кислород начинает выделяться гораздо раньше: в обычных условиях заряда при 50-80% заряженности (в зависимости от тока заряда), а при температуре 0 °С уже после заряда на 30-40 %. Вследствие этого отдача положительного электрода по емкости составляет 85-90 %. Для получения полной разрядной емкости при заряде аккумулятору должен быть обеспечен перезаряд на 10-20 %. Этот перезаряд сопровождается существенным выделением водорода на отрицательном электроде и кислорода - на положительном.
Выделение водорода имеет место и при хранении заряженного свинцово-кислотного аккумулятора. Саморазряд его определяется преимущественно скоростью растворения свинца согласно реакции:
Pb + H2SO4 > PbSO4 + H2
Скорость этого процесса зависит от температуры, объема электролита и его концентрации, но более всего от чистоты компонентов. В отсутствие примесей реакция протекает медленно из-за большого перенапряжения выделения водорода на свинце. Но на практике, на поверхности свинцового электрода всегда много примесей, среди которых наибольшее влияние оказывает сурьма, количество которой в сплаве для решеток и токоведущих деталей доходит до 6 %.
На положительном электроде может также самопроизвольно проходить реакция восстановления диоксида свинца:
PbO2 + H2SO4 > PbSO4 + 1/2O2 + H2O
в результате которой выделяется кислород, но скорость ее незначительна.
В процессе эксплуатации саморазряд аккумулятора может увеличиваться из-за образования дендритных мостиков из металлического свинца. Потери емкости свежеизготовленного аккумулятора за счет саморазряда как правило не превышают 2-3 % в месяц. Но при эксплуатации они быстро увеличиваются.
Особенности герметизированного свинцово-кислотного аккумулятора
Главные проблемы при создании герметичного варианта свинцово-кислотного аккумулятора связаны с необходимостью обеспечения условий для уменьшения газовыделения и содействия рекомбинации выделяющегося газа. При создании герметизированного аккумулятора, который в обычных условиях эксплуатации не требовал бы доливки воды в электролит в течение всего срока службы и не выделял бы газов, был предпринят ряд мер:
1. В аккумуляторе применяется иммобилизированный (обездвиженный) электролит, который сохраняет высокую электропроводность серной кислоты. Небольшое его количество позволяет обеспечить лучший транспорт кислорода от положительного электрода к отрицательному и высокий уровень его рекомбинации.
При одном методе иммобилизации электролита для его загущивания применяется силикагель (SiO2), который обладает высокой пластичностью и заполняет и электроды, и сепаратор. Благодаря своей вязкости он хорошо удерживается в порах и способствует эффективному использованию активных веществ электродов. Транспортировка кислорода обеспечивается по трещинам, которые появляются при усадке твердеющего электролита.
При другом методе иммобилизации применяется сепаратор из стекловолокна с высокой объемной пористостью и хорошей смачиваемостью в растворе серной кислоты. Такой сепаратор не только осуществляет функцию разделения электродов, но и благодаря тонкой структуре волокон обеспечивает удержание электролита в порах и высокую скорость переноса кислорода. Применение стекловолокнистого сепаратора и плотная сборка блока электродов способствуют также уменьшению оплывания активной массы положительного электрода и разбухания губчатого свинца на отрицательном.
2. Для снижения вероятности выделения водорода свинцово-сурьмяные сплавы токоведущих решеток заменяются другими, обеспечивающими более высокое перенапряжение выделения водорода. Применяются сплавы свинца с кальцием (до 0,1 % Ca), иногда легированного алюминием, сплавы свинца с оловом (0,5-2,5 % Sn), которые имеют неплохие литейные характеристики, и другие.
3. В отрицательный электрод закладывается емкость больше, чем в положительный. В данном случае при полном заряде положительного электрода оставшаяся недозаряженной часть активной массы отрицательного электрода практически исключает вероятность разряда ионов водорода. Кислород, выделяющийся на диоксиде свинца, достигает отрицательного электрода и окисляет губчатый свинец до оксида свинца, который в кислотном электролите переходит в сульфат свинца PbSO4 и воду. Следовательно, условия для герметизации аккумулятора улучшаются: газы не выделяются и вода не испаряется.
Снижению газовыделения способствуют и рекомендуемые для герметизированных аккумуляторов режимы заряда, при которых ток понижается по мере их заряжения.
И все-таки все реализованные варианты безуходного свинцово-кислотного аккумулятора оснащены клапаном, который время от времени открывается для сброса излишнего количества газа, главным образом водорода. Именно поэтому аккумулятор называется не герметичным, а герметизированным.
Успехи исследователей и технологов, достигнутые за прошедшие два десятилетия, тщательный контроль процесса изготовления и сотрудничество с потребителями, которые научились понимать, что безуходность этих батарей не означает полной свободы от контроля за их работой, позволяют в настоящее время выпускать на рынок продукцию, которая в ряде случаев может конкурировать с более дорогими герметичными щелочными аккумуляторами.
Герметизированные свинцово-кислотные аккумуляторные батареи емкостью до 10-20 Ач применяются как источники питания для разнообразной портативной аппаратуры и инструментов в тех случаях, когда масса не является определяющим критерием для выбора источника тока, а также в системах бесперебойного питания, телекоммуникаций, информационных системах, для аварийного оборудования и т.д., где они работают в буферном режиме.
Конструкция герметизированных свинцово-кислотных аккумуляторов
Портативные герметизированные свинцово-кислотные аккумуляторы выпускаются в виде батарей, которые собраны в едином призматическом контейнере из пластмассы или резины (моноблочная конструкция). Положительные и отрицательные электроды аккумуляторов делаются обычно намазкой на решетку сотовой структуры. Контейнер и крышка загерметизированы. Межэлементные соединения утапливаются в углублениях крышки и залиты мастикой. Выводы аккумуляторной батареи (в виде ушка или борна) также загерметизированы. Клапанное приспособление для сброса газа при излишнем давлении состоит из резинового клапана и отражателя, служащего для улавливания капель электролита. Воздух в аккумулятор через него не поступает.
На электрических и эксплуатационных характеристиках герметизированных свинцовых аккумуляторных батарей большой емкости значительно сказываются различия в конструкции электродов (поверхностного типа, панцирные или стержневые), а также различия в сплавах, используемых для изготовления токоведущих основ.
При выборе герметизированной свинцовой аккумуляторной батареи большой емкости следует внимательно отнестись к использованному в ней способу иммобилизации электролита, поскольку известно, что в высоких аккумуляторах со стекловолокнистым сепаратором (технология AGM) со временем отмечается расслоение электролита. Такие аккумуляторы стараются проектировать высотой не более 35 см.
Электрические и эксплуатационные характеристики герметизированных свинцово-кислотных аккумуляторов
Напряжение разомкнутой цепи свинцово-кислотных аккумуляторов линейно возрастает с ростом степени заряженности аккумулятора (рисунок 1). По значению напряжения разомкнутой цепи можно судить о степени разряда свинцового аккумулятора.
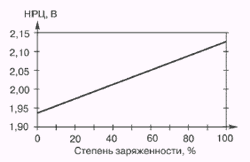
Рис.1. Зависимость напряжения разомкнутой цепи свинцово-кислотного аккумулятора от уровня заряженности
Номинальной емкостью свинцово-кислотного аккумулятора считается емкость, полученная при разряде в течение 20 ч, т.е. током 0,05С. Отдаваемая аккумулятором емкость значительно зависит от тока разряда, который может достигать нескольких С. Типичные разрядные характеристики при различных токах нагрузки показаны на рисунке 2. Из рисунка видно, что от тока разряда зависит также и конечное разрядное напряжение свинцового аккумулятора.
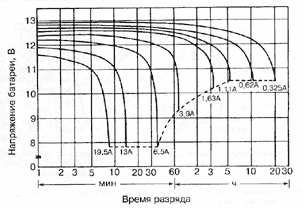
Рис.2. Разрядные характеристики герметизированной свинцово-кислотной аккумуляторной батареи
Герметизированные свинцовые аккумуляторные батареи работоспособны в интервале температур от -30 до +50 °С, чаще гарантируется работоспособность при температуре не ниже -15 °С. При более низких температурах возможности разряда мешает замерзание электролита. Работоспособность аккумуляторов при низких температурах может быть обеспечена увеличением концентрации электролита, как это и делается в специальных аккумуляторах.
Заряд свинцово-кислотного аккумулятора.
Заряд батарей, как было сказано ранее, должен осуществляться в режиме, при котором ток должен сильно понижаться к концу заряда. Используется несколько стратегий заряда, которые требуют оборудования различной сложности и стоимости. Наиболее простое и дешевое оборудование осуществляет заряд при постоянном напряжении 2,4-2,45В/ак (потенциостагический режим). Заряд считается законченным если ток заряда остается неизменным в течении 3-х часов.
Но чаще применяют комбинированный режим, при котором начальный ток ограничивают, а по достижении заданного напряжения, заряд проводится при стабилизации напряжения (рисунок 3). Заряд проводится при постоянном токе 0,1С на первом этапе и при постоянном напряжении источника тока на втором. Большинство производителей советуют проводить заряд циклируемых батарей при постоянном напряжении 2,4В на аккумулятор.
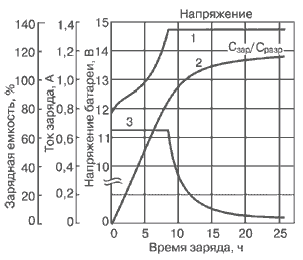
Рис.3. Зарядные кривые герметизированной свинцово-кислотной аккумуляторной батареи при комбинированном режиме заряда нормированным током 0,1С и нормированным напряжением 2,45В/ак:
1-напрядение, 2-зарядная емкость, 3-ток заряда
Ускорение процесса заряда достигается при повышении тока на первой стадии заряда, но в соответствии с советами производителей не более чем до 0,3С. В конце заряда для большей безопасности может быть применена еще одна ступень заряда: при снижении напряжения источника питания до напряжения подзаряда аккумулятора 2,30-2,35 В.
Заряд аккумуляторных батарей, используемых, для работы в буферном режиме, проводится как правило при более низком напряжении (2,23-2,275 В).
Указанные напряжения заряда не требуют изменения при заряде в некотором интервале температуры (обычно от 5 до 35 °С). За пределами указанного температурного интервала, требуется компенсация влияния температуры: повышение напряжения при пониженных температурах и снижение при более высоких.
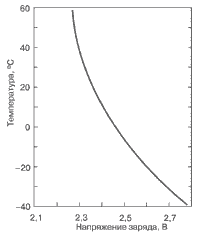
Рис.4. Рекомендуемое напряжение заряда при разных температурах для герметизированного свинцово-кислотного аккумулятора
Саморазряд свинцово-кислотной аккумуляторной батареи.
Саморазряд в герметизированных свинцово-кислотных аккумуляторах значительно уменьшен по сравнению с вентилируемыми аккумуляторами и составляет 40% в год при 20 °С и 15% при 5 °С. При более высоких температурах хранения саморазряд увеличивается: при 40 °С батареи лишаются 40 % емкости за 4-5 месяцев.
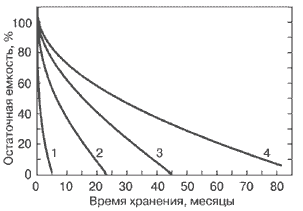
Рис.5. Действие температуры на остаточную емкость герметизированного свинцово-кислотного аккумулятора:
1-40°С, 2-20°С, 3-10°С, 4-0°С
При продолжительном хранении в заряженном состоянии батареи рекомендуют периодически подзаряжать. Если они хранились при температуре ниже -20 °С, то подзаряд должен проводиться 1 раз в год в течение 48 ч при постоянном напряжении 2,275 В/ак. При хранении при комнатной температуре - 1 раз в 8 месяцев в течение 6-12 ч при постоянном напряжении 2,4 В/ак. Хранение при температуре выше 30 °С не желателен.
Продолжительное хранение батареи в разряженном состоянии приводит к быстрой потере ее работоспособности.
Изменения характеристик свинцово-кислотных аккумуляторов при эксплуатации
Срок службы герметизированных свинцово-кислотных аккумуляторных батарей, как и вентилируемых, в большинстве случаев определяется деградацией положительного электрода, которая определяется коррозией его решетки и изменениями в активной массе.
Скорость коррозии решеток зависит как от состава сплава, конструкции и условий отливки, так и от температуры, при которой работают батареи. Коррозия решетки из сплава без сурьмы или с низким ее содержанием существенно медленнее по сравнению с коррозией традиционных решеток вентилируемых аккумуляторов. В качественно отлитых решетках из сплавов Pb-Ca-Sn скорость коррозии маленькая, но в плохо отлитых - отдельные участки подвергаются глубокой коррозии, что вызывает локальный ее рост и деформацию. Деформация решеток может привести к короткому замыканию разнополярных пластин. Коррозия решеток положительных пластин - самый частый дефект батарей, эксплуатируемых в буферном режиме.
При эксплуатации в режиме циклирования происходит также разрыхление активных масс положительного электрода, которое приводит к потере контакта между частицами PbO2. Емкость источника тока при этом уменьшается. Процесс разрыхления ускоряется при разряде большими импульсами тока.
В герметизированных аккумуляторах могут протекать и специфические коррозионные процессы на токоведущих деталях отрицательных пластин, которые находятся выше уровня электролита, и на борне. Так как продукты коррозии имеют больший объем, чем свинец, в результате может иметь место выдавливание компаунда, герметизирующего вывод, и повреждение борна, крышки и даже бака. Дефекты такого рода часто отмечались в аккумуляторах разных производителей на ранних этапах разработок и производства. Сейчас большая часть производителей решила эту проблему подбором сплавов для всех компонентов аккумулятора и контролем за металлургическим процессом их изготовления.
В течении эксплуатации герметизированных аккумуляторов из-за неизбежных потерь воды при открывании клапана для сброса излишнего давления газа происходит некоторое осушение сепаратора и повышение внутреннего сопротивления аккумулятора. При эксплуатации в буферном режиме количество отказов, спровоцированных высыханием аккумулятора, становится соизмеримым с отказами из-за коррозии решеток положительных электродов. В аккумуляторах с гелиевым электролитом снижение количества электролита менее критично, чем в аккумуляторах с сепаратором из стекловолокна.
Факторы, влияющие на срок службы свинцово-кислотных аккумуляторов
Самое большое влияние на срок службы герметизированного свинцово-кислотного аккумулятора оказывают: рабочая температура, глубина разряда и величина перезаряда, а также периодичность срабатывания клапана для сброса газа.
На рисунках 6 и 7 изображено изменение срока службы в зависимости от глубины разряда и температуры окружающей среды..
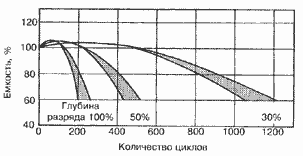
Рис.6. Зависимость срока службы герметизированной свинцово-кислотной батареи от глубины разряда
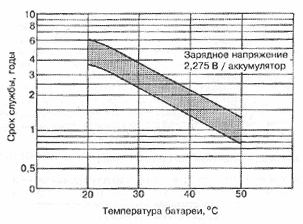
Рис.7. Зависимость срока службы герметизированной свинцово-кислотной батареи от температуры при работе в буферном режиме
Герметизированные свинцово-кислотные аккумуляторы очень чувствительны к перезаряду. На рисунке 8 изображено, как быстро уменьшается срок их службы при работе в режиме постоянного подзаряда при повышении напряжения (и тем самым - тока подзаряда) источника питания подключенного к аккумулятору.
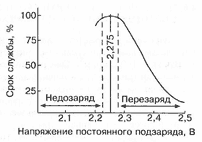
Рис.8. Воздействие режима заряда на срок службы герметизированной свинцово-кислотной аккумуляторной батареи при работе в буферном режиме
Следует помнить, что при заряде герметизированных аккумуляторов их температура может быть значительно выше температуры окружающей среды. Это связано как с разогревом аккумуляторов из-за реакции рекомбинации кислорода, так и с неудовлетворительным отводом тепла от плотноупакованной батареи. Разница температур особенно ощутима при ускоренном режиме заряда. Если нельзя избежать существенного увеличения температуры, то при заряде следует вводить корректировку напряжения источника питания.
Переразряд также вреден для свинцово-кислотных батарей, как и перезаряд. При многократных переразрядах уменьшается разрядная емкость и понижается срок службы аккумулятора. Такие же изменения могут происходить и при продолжительном хранении батарей в разряженном состоянии.
В связи с расширением сферы применения герметизированных свинцовых аккумуляторов до обитаемых комплексов специального назначения, где должны применяться мощные источники тока с большим напряжением, стало необходимым исследование последствий возникновения аварийных ситуаций в эксплуатации. Такие ситуации могут происходить как при разбалансировании характеристик аккумуляторов, составляющих батарею, так и в результате ошибочного обслуживания батарей или отказе управляющего оборудования. В этом случае при перезаряде или переразряде батарей, приводящем к переполюсованию наиболее слабых аккумуляторов, может произойти разгерметизация аккумуляторов или даже разрушение их баков.
Было показано, что повреждение корпуса приводит к снижению отдаваемой емкости, но более серьезных проблем не возникает. Даже при полном разрушении контейнера аккумулятора емкость его стала меньше только на 14 %, так как электролит не вытекает, а задерживается в порах электродов и сепаратора. При вскрытии 5 % площади контейнера, аккумуляторы оставались годными для циклирования при снижении разрядной емкости на 15-20 %.
При продолжительном перезаряде (током 0,25 Сн) как свежих аккумуляторов, так и после полтора года эксплуатации в режиме постоянного подзаряда, а также при заряде аккумуляторов при завышенном напряжении (2,6В), чрезвычайного разогрева аккумуляторов не происходило. Температура стабилизируется спустя 4-6 ч на уровне 50-70 °С или затем медленно понижается. Но из-за выброса газов через аварийный клапан происходит осушение аккумуляторов и быстрая их деградация.
Современные герметизированные свинцово-кислотные аккумуляторные батареи обладают достаточно высокими удельными энергетическими характеристиками (до 40 Втч/кг и 100 Втч/л). Они работоспособны в буферном режиме при нормальной температуре в течение продолжительного периода (более 10 лет), а при циклировании обеспечивают несколько сотен циклов до потери 20 % емкости.
Свинцовые стартерные аккумуляторы являются наиболее массовым и недорогим химическим источником тока, благодаря относительной дешевизне используемых материалов и высокой степени автоматизации производства.
Наилучшие образцы первых аккумуляторов, конца 19в., имели удельную энергию по массе 7-8 Вт•ч/кг при продолжительном разряде (у нынешних образцов 40-47 Вт•ч/кг).
Сейчас выпускаются герметизированный автомобильные аккумуляторы с иммобилизованным (гелеобразным или абсорбированным) электролитом, эти аккумуляторы обеспечивают работоспособность в любом пространственном положении и применяются в системах резервного и аварийного энергоснабжения, бытовой технике и т.п.
Активными веществами свинцового аккумулятора, принимающими участие в токообразующих реакциях, являются:
• на положительном электроде - двуокись свинца PbO2 (темно-коричневого цвета);
• на отрицательном электроде - губчатый свинец Pb (серого цвета);
• электролит - водный раствор серной кислоты H2SO4
В ходе разряда аккумулятора активная масса отрицательного электрода превращается из губчатого свинца в сульфат свинца, со сменой серого цвета на светло-серый, отдавая два электрона в электрическую цепь.
Pb + HSO4- > PbSO4 + H+ + 2e-
Активная масса положительного электрода по ходу разряда превращается из двуокиси свинца PbO2, так же как и активная масса отрицательного электрода, в сульфат свинца PbSO4 с изменением цвета с темно-коричневого на светло-коричневый, поглощая два електрона.
PbO2 + HSO4- + 3H+ + 2e- > PbSO4 + 2H2O
В результате разряда аккумулятора активные материалы и положительного (PbO2), и отрицательного (Pb) электродов преобразуются в сульфат свинца PbSO4. При этом на формирование сульфата свинца расходуется серная кислота, что вызывает снижение концентрации электролита и как следствие снижение его плотности. Суммарная реакция при разряде аккумулятора:
PbO2 + Pb + 2H2SO4 > 2PbSO4 + 2H2O
При зарядке аккумулятора идут обратные в противоположную сторону, в ходе которых кроме всего прочего происходит образование серной кислоты, в результате чего при заряде растет плотность электролита. Суммарное уравнение процесса заряда:
2PbSO4 + 2H2O > PbO2 + Pb + 2H2SO4
Когда реакции преобразования веществ в активных массах положительного и отрицательного электродов завершены, плотность электролита перестает меняться, что служит признаком завершения заряда аккумулятора. При дальнейшем продолжении заряда протекает так называемый вторичный процесс - электролитическое разложение воды на кислород и водород. Выделяясь из электролита в виде пузырьков газа, они создают иллюзию кипения электролита, что тоже служит признаком завершения процесса заряда.
Каждый аккумулятор состоит из пространственно разделенных разноименных электродов, погруженных в раствор электролита и помещенных в прочный корпус, который устойчив к химическому воздействию электролита, механическим нагрузкам и температурным колебаниям.
Активная масса электродов обладает высокой пористость (47-60%) и у заряженных аккумуляторов на положительном электроде состоит в основном из двуокиси свинца PbO2 (85-90 %), а на отрицательном электроде - из губчатого свинца Pb (80-90 %).
Раньше для изготовления корпуса аккумуляторов использовали эбонит, который обладает относительно низкой механической прочностью. Поэтому стенки эбонитовых блоков имеют толщину 6-8 мм для аккумуляторных батарей до 90 А•ч и 9-12 мм при емкости более 100 А•ч. При переходе с эбонита на сополимер полипропилена с этиленом, удается уменьшить толщину стенок в два раза и понизить массу корпусных деталей без ухудшения их надежности.
Необслуживаемые автомобильные аккумуляторы
Традиционные автомобильные аккумуляторы имеют недостатки связанные с тем, что сурьма, содержащаяся в сплаве положительных токоотводов, постепенно, по мере их коррозии, переходит через раствор на поверхность отрицательного электрода. Накопление большого количества сурьмы на поверхности отрицательной активной массы понижает напряжение начала газовыделения. Вследствие этого в конце зарядного процесса происходит все более бурное газовыделение, напоминающее кипение электролита. Это ведет к потери воды из-за ее электролитического разложения и испарения вместе с образующимися газами.
За последние десятилетия произошло стремительное развитие технологии и совершенствование оборудования для аккумуляторного производства. В итоге на рынке появилось несколько видов, так называемых, необслуживаемых автомобильных аккумуляторов. Особенностью таких аккумуляторов является использование для производства токоотводов, сплавов без сурьмы или с ее пониженным содержанием. Необслуживаемые аккумуляторы начали изготавливать в США в конце семидесятых годов прошлого столетия. Для токоотводов и положительного, и отрицательного электродов применялся свинцово-кальциевый сплав с содержанием кальция 0,07-0,1% и олова 0,1-0,12% (остальное - свинец). Это позволило достигнуть значительного снижения газовыделения, которое обеспечивало эксплуатацию аккумуляторов без доливки воды в течение 2 лет и более. При этом саморазряд замедлился более чем в шесть раз. Но после двух-трех глубоких разрядов такие аккумуляторы теряют 40-50% емкости и их стартерные характеристики также значительно снижаются. Поэтому такие аккумуляторы не нашли широкого распространения в Европе и России. Почти одновременно со свинцово-кальциевой технологией производства аккумуляторных батарей необслуживаемого исполнения, в США появилась технология гибридных аккумуляторов - система "кальций плюс" с содержанием до 1,5-1,8% сурьмы и 1,4-1,6% кадмия в положительном токоотводе и отрицательным свинцово-кальциевым токоотводом. В начале восьмидесятых годов производство необслуживаемых аккумуляторов стало стремительно развиваться и в странах Европы. Здесь пошли по пути использования сплавов с пониженным до 2,5-3,0% содержанием сурьмы. У таких аккумуляторов расход воды и саморазряд были в 2-3 раза выше, чем у батарей с кальциевыми токоотводами, хотя и значительно ниже, чем у батарей традиционного исполнения. Они могли работать без доливки воды не менее 1 года.
Далее в Европе появляются гибридные аккумуляторные батареи, у которых положительные токоотводы изготовлены из малосурьмяного сплава (не более 2%) с добавлением мышьяка, олова, меди, селена и т.п. в различных сочетаниях и соотношениях; а отрицательные - из свинцово-кальциевого сплава. Их характеристики по расходу воды и саморазряду, как и у американских гибридных аккумуляторов, не такие хорошие, как у свинцово-кальциевых, но все же существенно лучше, чем у батарей по технологии малосурьмяных сплавов.
В конце 90-х годов в США и Западной Европе начинается производство аккумуляторов с токоотводами из свинцово-кальциевого сплава с многокомпонентными добавками, в том числе и серебра, которые при глубоких разрядах теряют емкость гораздо медленнее, чем первое поколение аккумуляторных батарей по свинцово-кальциевой технологии. Расход воды у них так мал, что конструкторы убирают с крышек отверстия для доливки воды и делают аккумуляторные батареи полностью необслуживаемыми и исключающими доступ к электролиту при использовании аккумулятора.
Такое изменение конструкции стало возможным благодаря общим усилиям производителей аккумуляторов и автомобильного электрооборудования. Ведь для максимального использования ресурса полностью необслуживаемой аккумуляторной батареи (без отверстий для доливки воды) необходимо обеспечить стабильное зарядное напряжение, обеспечивающие минимальное разложение воды при заряде аккумуляторов. В то же время, степень заряженности аккумуляторной батареи должна быть достаточной для безотказной работы всего электрооборудования. Это стало возможно благодаря созданию системы регулирования зарядного напряжения, обеспечивающей его стабильность с точностью ± 0,1 В.
Но владельцы автомобилей, решившие использовать необслуживаемые аккумуляторы без отверстий для доливки воды, должны более внимательно относиться к обеспечению исправной работы электрооборудования. Прежде всего это касается натяжения ремня привода генератора, исправности самого генератора, регулятора напряжения, отсутствия утечек тока в системе электрооборудования или сигнализации и ряда других факторов.
Автомобильные аккумуляторы, у которых отсутствуют отверстия для доливки воды и имеется только атмосферная связь внутренней полости с окружающей средой через небольшие вентиляционные отверстия на торцах крышки, как правило оснащены индикатором состояния заряженности (рисунок 1): шарик-поплавок зеленого цвета расположен над пластинами, который всплывает, когда электролит при заряде достигает определенной плотности. Эта величина соответствует минимальной степени заряженности (62-64% от номинального значения), при которой индикатор начинает давать информацию о работоспособности аккумуляторной батареи в пусковом режиме. Последующее увеличение плотности электролита (до 100 % заряда) не меняет показания индикатора, что является недостатком данного приспособления. В случаях понижения уровня электролита до оголения пластин, информация индикатора о состоянии заряженности батареи прекращается. При работающем индикаторе его информация относится только к одной из шести банок (ячеек) аккумуляторной батареи. В тех случаях, когда появляется дефект в другой банке, где нет индикатора, информация индикатора становится бесполезной, не отражающей общее состояние (работоспособность) аккумуляторной батареи. Использование индикатора дает полезную информацию о состоянии батареи в тех случаях, когда она не содержит дефекта производственного характера.
Рис.1 Индикатор заряженности аккумулятора
Герметизированные автомобильные аккумуляторы с иммобилизованным электролитом
Создание полностью необслуживаемого автомобильного аккумулятора свинцово-кислотной системы становится возможным, если его конструкцию поменять таким образом, чтобы связать выделяющийся на положительном электроде кислород на поверхности отрицательного электрода (реализация кислородного цикла). Для этого емкость отрицательных электродов в аккумуляторе должна быть на несколько процентов больше емкости положительных. Тогда в ходе заряда положительные электроды полностью зарядятся раньше, чем отрицательные. Благодаря этому активное выделение кислорода на положительном электроде начнется до начала активного выделения водорода на отрицательном. Образующийся кислород вступает в химическое взаимодействие с активной массой отрицательного электрода. Для увеличения скорости поступления кислорода от положительного электрода к отрицательному, необходимо ограничение объема свободного электролита. Поэтому для производства герметизированных батарей разработаны способы связывания жидкого электролита:
• создание загущенного (гелеобразного) электролита;
• адсорбция жидкого электролита в сепараторах с высокой объемной пористостью.
Искусственное ограничение емкости положительных электродов и объема электролита ведут к тому, что емкость герметизированных свинцовых аккумуляторов с иммобилизованным электролитом на 15-20% меньше, чем батарей со свободным электролитом таково же объема и массы.
В качестве загустителя для создания гелеобразного электролита применяют силикагель, аллюмогель и другие вещества. При смачивании серной кислотой эти вещества образуют тиксотропный гель. В качестве сепараторов в подавляющем большинстве герметизированных аккумуляторов используют стекломаты из ультратонких волокон. Объемная пористость современных стеклосепараторов достигает 80-85%. Благодаря этому их применяют не только для батарей с гелеобразным электролитом, но и для аккумуляторов с адсорбированным жидким электролитом. В последнем случае технология производства немного дешевле, но емкостные показатели хуже, чем у автомобильных аккумуляторов с гелеобразным электролитом. Это обусловлено еще большим снижением количества электролита в аккумуляторе.
Свинцовые аккумуляторные батареи с иммобилизованным электролитом являются герметизированными, но не являются герметичными как, например, никель-кадмиевые герметичные аккумуляторы. Во всех свинцовых герметизированных аккумуляторах есть предохранительный клапан. Он служит для того, чтобы давление внутри аккумулятора не превышало величины, которая является допустимой по условиям работоспособности и прочности корпусных деталей аккумулятора. Дело в том, что, несмотря на используемые ограничения емкости положительных электродов, выделение водорода на отрицательном электроде в процессе заряда, особенно на завершающей стадии, полностью подавить невозможно. Причем скорость его выделения в конце заряда несколько выше, чем скорость выделения кислорода. Избыточная часть водорода вызывает увеличение давления внутри аккумулятора, для ограничения которого и служит клапан.
Нормальная эксплуатация герметизированных свинцовых автомобильных аккумуляторов возможна при соблюдении гораздо более жесткого диапазона регулирования зарядного напряжения, чем при эксплуатации необслуживаемых аккумуляторов с жидким электролитом (даже не имеющих отверстий для доливки воды). Максимальная величина зарядного напряжения для автомобильных аккумуляторных батарей с загущенным (гелеобразным) и адсорбированным электролитом зависит от рекомендаций производителя (ориентировочно для гелеобразных 14,35В, а для адсорбированных 14,4В). В случае превышения величины рекомендованной производителем на 0,05В скорость газовыделения становится так велика, что ведет к нарушению контакта активной массы электродов с электролитом, а также к высыханию аккумулятора, в результате чего батарея утрачивает работоспособность.
Весьма жесткие ограничения величины зарядного напряжения, наряду с гораздо более высокой стоимостью герметизированных автомобильных аккумуляторных батарей в сравнении с необслуживаемыми, создают определенные трудности для их широкого использования на автомобилях.
Емкость аккумулятора
Емкость аккумулятора - это количество электричества, полученное от аккумулятора при его разряде до определенного конечного напряжения. В практических расчетах емкость аккумулятора принято выражать в ампер-часах (А•ч). Разрядную емкость Cp можно рассчитать, умножив силу разрядного тока Ip на продолжительность разряда Tp (при условии, что Ip остается постоянной)
Cp=Ip•Tp
Разрядная емкость, на которую рассчитан аккумулятор и которая указывается изготовителем, называется номинальной емкостью. Кроме нее, важным показателем является также емкость, сообщаемая аккумуляторной батарее при заряде, которая вычисляется по формуле (при Iз = const):
Cз = Iз • Tз
Разрядная емкость аккумулятора зависит от целого ряда конструктивных и технологических параметров, а также от условий эксплуатации аккумулятора. Наиболее значимыми конструктивными параметрами являются количество активной массы и электролита, толщина и геометрические размеры аккумуляторных электродов. Главными технологическими параметрами, влияющими на емкость аккумулятора, являются рецептура активных материалов и их пористость. Эксплуатационные параметры - температура электролита и сила разрядного тока - также оказывают существенное влияние на разрядную емкость.
Обобщенным показателем, характеризующим эффективность работы аккумулятора, является коэффициент использования активных материалов ?,%:
? = (Cp / Co) • 100%
где Cp - емкость аккумулятора, полученная при его разряде, А•ч; Co - теоретическая емкость того же аккумулятора, рассчитанная по электрохимическим эквивалентам, А•ч.
Для получения емкости в 1 А•ч, по закону Фарадея, теоретически необходимо 4,462г двуокиси свинца PbO2, 3,865г губчатого свинца Pb и 3,659г серной кислоты H2SO4. Теоретический удельный расход активных масс электродов и серной кислоты, после суммирования получается 11,986 г/А•ч. Однако на практике нереально достигнуть полного использования активных материалов, принимающих участие в токообразующем процессе. Примерно половина поверхности активной массы недоступна для электролита, так как является основой для создания объемного пористого каркаса, обеспечивающего механическую прочность материала. Вследствие этого реальный коэффициент использования активных масс положительного электрода составляет 45-55%, а отрицательного 50-65%. Кроме этого, в качестве электролита используется 35-38%-ый раствор серной кислоты. Таким образом величина реального удельного расхода материалов существенно выше, а реальные значения удельной емкости и удельной энергии существенно ниже, чем теоретические.
На уровень использования активной массы, а следовательно, и на величину разрядной емкости оказывают влияние следующие основные факторы.
Пористость активной массы. С повышением пористости улучшаются условия диффузии электролита в глубину активной массы электрода и возрастает истинная поверхность, на которой протекает токообразующая реакция. С увеличением пористости повышается разрядная емкость. Величина пористости зависит от размеров частиц свинцового порошка и рецептуры приготовления активных масс, а также от используемых добавок. Причем повышение пористости ведет к уменьшению долговечности вследствие ускорения процесса деструкции высокопористых активных масс. Поэтому уровень пористости выбирается производителями с учетом не только высоких емкостных характеристик, но и обеспечения требуемой долговечности батареи в эксплуатации. Сейчас оптимальной считается пористость в пределах 46-60%, в зависимости от предназначения аккумулятора.
Толщина электродов. С понижением толщины снижается неравномерность нагруженности внешних и внутренних слоев активной массы электрода, что способствует повышению разрядной емкости. У более толстых электродов внутренние слои активной массы используются очень незначительно, в особенности при разряде большими токами.
Пористость материала сепаратора. С возрастанием пористости сепаратора и высоты его ребер повышается запас электролита в межэлектродном зазоре и улучшаются условия его диффузии.
Концентрация электролита. При повышении концентрации серной кислоты емкость положительных электродов повышается, а емкость отрицательных, особенно при отрицательной температуре, снижается вследствие ускорения пассивации поверхности электрода. Повышенная концентрация также отрицательно сказывается на сроке службы аккумулятора вследствие ускорения коррозионных реакций на положительном электроде. Поэтому оптимальная концентрация электролита устанавливается исходя из совокупности требований и условий, в которых эксплуатируются аккумуляторы. Так, например, для стартерных аккумуляторов, работающих в умеренном климате, рекомендована рабочая концентрация при которой плотность электролита равна 1,26-1,28 г/см3, а для районов с жарким (тропическим) климатом плотность электролита должна быть 1,22-1,24 г/см3.
Сила разрядного тока. Режимы разряда условно разделяют на длительные и короткие. При длительных режимах, разряд совершается малыми токами в ходе нескольких часов. Например, 5-, 10- и 20-часовой разряды. При коротких или стартерных разрядах сила тока в несколько раз больше номинальной емкости аккумулятора, а разряд продолжается несколько минут или секунд. При повышении разрядного тока скорость разряда поверхностных слоев активной массы возрастает в большей степени, чем глубинных. В результате рост сернокислого свинца в устьях пор происходит быстрее, чем в глубине, и пора закупоривается сульфатом раньше, чем успевает прореагировать ее внутренняя поверхность. Вследствие прекращения диффузии электролита внутрь поры реакция в ней прекращается. Следственно, чем больше разрядный ток, тем ниже емкость аккумулятора, а следовательно, и коэффициент использования активной массы. Так, например, при разряде батареи емкостью 55 А•ч током 2,75 А при температуре электролита +25 °С ее емкость составляет C20=55?60А•ч, а при разряде током 255А (4,6C20) емкость уменьшается более чем в 2 раза и составляет всего 22А•ч. Для оценки пусковых качеств автомобильных аккумуляторов, их емкость характеризуется также количеством прерывистых стартерных разрядов (например, длительностью 10-15с с паузами между ними по 60с). Емкость, которую отдает батарея при прерывистых разрядах, превосходит емкость при непрерывном разряде тем же током, в особенности при стартерном режиме разряда (Ip = 2?5 C20). В настоящее время в международной практике оценки емкостных характеристик стартерных аккумуляторов используется понятие "резервная" емкость. Она характеризует время разряда батареи (в минутах) при силе разрядного тока 25А независимо от номинальной емкости аккумуляторной батареи. По усмотрению изготовителя допускается устанавливать величину номинальной емкости при 20-часовом режиме разряда в ампер-часах или по резервной емкости в минутах.
Температура электролита. С понижением температуры разрядная емкость аккумуляторов понижается. Причина этого - повышение вязкости электролита и его электрического сопротивления, что замедляет скорость диффузии электролита в поры активной массы. Зависимость времени разряда Тр автомобильных аккумуляторов от силы разрядного тока Iр при различных температурах от +25 °С до -30 °С приведена на рисунке 2 (для различных аккумуляторов значения могут отличаться).
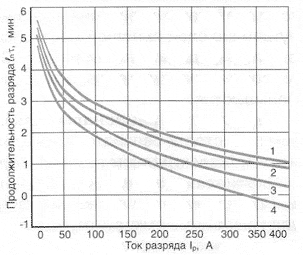
Рис.2 Зависимость продолжительности разряда необслуживаемой аккумуляторной батареи от силы тока при различных температурах:
1 - (+25°C), 2 - (0°C), 3 - (-18°С), 4 - (-30°С)
Саморазряд автомобильного аккумулятора
Саморазрядом называют уменьшение емкости аккумуляторов при разомкнутой внешней цепи, то есть при бездействии. Это явление вызвано окислительно-восстановительными реакциями, самопроизвольно проходящими как на отрицательном, так и на положительном электродах. Саморазряду в особенности подвержен отрицательный электрод вследствие самопроизвольного растворения свинца (отрицательной активной массы) в растворе серной кислоты по реакции:
Pb + H2SO4 > PbSO4 + H2^.
Саморазряд отрицательного электрода сопровождается выделением газообразного водорода. Скорость самопроизвольного растворения свинца существенно повышается с увеличением концентрации серной кислоты. Повышение плотности электролита с 1,27 до 1,32 г/см3 ведет к росту скорости саморазряда отрицательного электрода на 40%.
Присутствие примесей разных металлов на поверхности отрицательного электрода оказывает весьма существенное влияние (каталитическое) на рост скорости саморастворения свинца (вследствие понижения перенапряжения выделения водорода). Практически все металлы, встречающиеся в виде примесей в аккумуляторном сырье, электролите и сепараторах, способствуют увеличению саморазряда. Попадая на поверхность отрицательного электрода, они облегчают условия выделения водорода. Часть примесей (соли металлов с переменной валентностью) действуют как переносчики зарядов с одного электрода на другой. В таком случае ионы металлов восстанавливаются на отрицательном электроде и окисляются на положительном (такой механизм саморазряда приписывают ионам железа).
Саморазряд положительного активного материала обусловлен протеканием реакции:
2PbO2 + 2H2SO4 > PbSO4 + 2H2O + O2^.
Скорость данной реакции также увеличивается с ростом концентрации электролита. Скорость саморазряда положительного активного материала в несколько раз ниже скорости саморазряда отрицательного активного материала.
Еще одной причиной саморазряда положительного электрода является разность потенциалов материала токоотвода и активной массы этого электрода. Возникающий вследствие этой разности потенциалов гальванический микроэлемент превращает, при протекании тока, свинец токоотвода и двуокись свинца положительной активной массы в сульфат свинца.
Саморазряд может возникать также, когда аккумулятор снаружи загрязнен или залит электролитом, водой или другими жидкостями, которые создают возможность разряда через электропроводную пленку, находящуюся между полюсными выводами аккумулятора или его перемычками. Этот тип саморазряда не отличается от обычного разряда очень малыми токами при замкнутой внешней цепи и легко устраняется. Для этого необходимо содержать поверхность автомобильного аккумулятора в чистоте.
Саморазряд аккумуляторов в значительной мере зависит от температуры электролита. Эта зависимость показана на рисунке 3, где видно, что с уменьшением температуры саморазряд понижается. При температуре ниже 0°С у новых аккумуляторных батарей он практически прекращается. Поэтому хранить автомобильные аккумуляторы рекомендуется в заряженном состоянии при низких температурах (до -30 °С). Из рисунка также видно, что в течении эксплуатации саморазряд не остается постоянным и резко усиливается к концу срока службы.
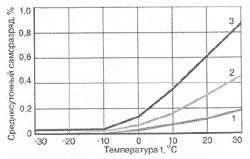
Рис.3 Среднесуточный саморазряд необслуживаемой аккумуляторной батареи за три месяца в зависимости от температуры и продолжительности эксплуатации (содержание Sb - 2,5%):
1 - новый аккумулятор, 2 - аккумулятор после среднего срока эксплуатации, 3 - аккумулятор в конце срока службы
Понижение саморазряда возможно за счет использования наиболее чистых материалов для производства аккумуляторов; за счет уменьшения количественного содержание легирующих элементов в аккумуляторных сплавах; за счет использования только чистой серной кислоты и дистиллированной воды (или близкой к ней по чистоте при других методах очистки) для получения всех электролитов, как при производстве, так и при эксплуатации. Например, благодаря понижению содержания сурьмы в сплаве токоотводов с 5% до 2% и использованию дистиллированной воды для всех технологических электролитов, среднесуточный саморазряд уменьшается в 4 раза. Замена сурьмы на кальций позволяет еще больше уменьшить скорость саморазряда (рисунок 4). Снижению скорости саморазряда могут также способствовать добавки органических ингибиторов саморазряда.
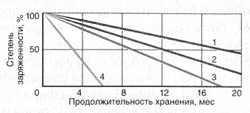
Рис.4 Изменение уровня заряженности автомобильных аккумуляторов различных конструкций при хранении:
1 - аккумуляторы со свинцово-кальциевыми сплавами, 2 - гибридные аккумуляторы, 3 - аккумуляторы с малосурьмяными сплавами, 4 - аккумуляторы традиционного исполнения
Зарядка аккумулятора при постоянном токе
При подобном заряде сила тока в ходе всего времени заряда должна оставаться постоянной. Для этого в ходе заряда надо менять напряжение зарядного устройства или сопротивление цепи. Имеется несколько методов регулирования силы зарядного тока. Основные из них:
• подключение в зарядную цепь реостата;
• использование регуляторов силы тока (например, тиристорных), которые периодическим включением и выключением дополнительного сопротивления в цепи заряда изменяют силу тока таким образом, чтобы его среднее значение сохранялось постоянным;
• изменение напряжения источника тока ручным или автоматическим регулятором в соответствии с показаниями силы тока, корректируя его до требуемого постоянного значения.
Большинство выпрямительных приборов, предназначенных для заряда, питается от сети переменного тока и имеет или ступенчатую, или плавную регулировку напряжения за счет изменения коэффициента трансформации. Вследствие этого в процессе заряда приходится периодически вручную регулировать напряжение.
Коэффициент полезного действия заряда при комнатной температуре для исправных батарей может быть принят равным 85-95% при токе заряда не более 0,1С20
Коэффициент использования тока зависит от силы зарядного тока, уровня заряженности батареи и температуры электролита. Он будет тем меньше, чем больше зарядный ток, чем выше уровень заряженности и чем ниже температура электролита. При зарядке полностью разряженных батарей при комнатной температуре, процесс заряда в начальный момент идет с наибольшим коэффициентом использования тока. Увеличение степени заряженности и повышение поляризации ведут к повышению суммарного внутреннего сопротивления батареи и повышению потерь энергии на нагрев электролита, электродов и прочих компонентов батареи. Кроме того, на финальной стадии заряда аккумуляторов начинается вторичный процесс - электролиз воды, входящей в состав электролита.
Выделяющийся при электролизе воды газ создает видимость кипения электролита, что свидетельствует об окончании процесса зарядки аккумуляторов. Для снижения потерь энергии при зарядке, уменьшения нагрева батареи и предохранения уровня электролита от чрезмерного снижения, рекомендуется в конце процесса заряда понижать силу зарядного тока.
При зарядке постоянным током наиболее распространенным является режим, который состоит из двух стадий. Первая стадия заряда производится при токе равном 0,1С20 до тех пор, пока напряжение на батарее 12 В не достигнет 14,4 В (2,4В на каждом аккумуляторе). Затем сила зарядного тока уменьшается вдвое до величины 0,05С20. Зарядка при такой силе тока длится до неизменности напряжения и плотности электролита в аккумуляторах в течение 2ч. При этом в конце заряда происходит бурное выделение газа ("кипение" электролита).
В ходе зарядки аккумуляторов с гелиевым или адсорбированным электролитом следует четко следовать рекомендациям производителя. В противном случаи малейшее отклонение от оптимального режима может привести к порче аккумулятора.
Уменьшенная сила тока в конце заряда позволяет снизить скорость газовыделения, уменьшить влияние перегрева на последующую работоспособность и срок службы батареи, а также обеспечить полноту заряда.
Уравнительная зарядка аккумуляторов. Такая зарядка производится при постоянной силе тока менее 0,1 от номинальной емкости в течение немного большего времени, чем обычно. Его цель - обеспечить полное восстановление активных масс во всех электродах всех аккумуляторов батареи. Уравнительный заряд нейтрализует влияние глубоких разрядов и рекомендуется как мера, устраняющая нарастающую сульфатацию электродов. Зарядка длится до тех пор, пока во всех аккумуляторах батареи не будет наблюдаться постоянство плотности электролита и напряжения на протяжении трех часов.
Форсированная зарядка аккумуляторов. В случаи потребности в короткое время восстановить работоспособность глубоко разряженной аккумуляторной батареи, используют так называемую форсированную зарядку. Такая зарядка может производиться токами величиной до 70% от номинальной емкости, но на протяжении более короткого времени. Время заряда тем меньше, чем больше величина зарядного тока. Практически при заряде током 0,7С20 длительность зарядки не должна быть более 30 мин, при 0,5С20 - 45 мин, а при 0,3С20 - 90 мин. В ходе форсированного заряда нужно контролировать температуру электролита, и при достижении 45 °С прекращать зарядку.
Нужно отметить, что использование форсированного заряда должно быть исключением, так как его регулярное многократное повторение для одной и той же батареи, заметно укорачивает срок ее службы.
Зарядка автомобильного аккумулятора при постоянном напряжении
При этом методе, в течение всего времени заряда напряжение зарядного устройства остается постоянным. Зарядный ток убывает в ходе заряда по причине повышения внутреннего сопротивления батареи. В первый момент после включения, сила зарядного тока определяется следующими факторами: выходным напряжением источника питания, уровнем заряженности батареи и числом последовательно включенных батарей, а также температурой электролита батарей. Сила зарядного тока в первоначальный момент заряда может достигать (1,0-1,5)С20.
Для исправных, но разряженных автомобильных аккумуляторов такие токи не принесут вредных последствий. Несмотря на большие токи в первоначальный момент зарядного процесса, общая длительность полного заряда аккумуляторных батарей приблизительно соответствует режиму при постоянстве тока. Дело в том, что завершающий этап заряда при постоянстве напряжения происходит при достаточно малой силе тока. Однако, заряд по такой методике в ряде случаев предпочтителен, так как он обеспечивает более быстрое доведение батареи до состояния, позволяющего обеспечить пуск двигателя. Кроме того, сообщаемая на первоначальном этапе заряда энергия тратится преимущественно на основной зарядный процесс, то есть на восстановление активной массы электродов. При этом реакция газообразования в аккумуляторе еще не возможна.
Итак, зарядка при постоянстве напряжения позволяет ускорять процесс заряда аккумуляторов при подготовке к использованию.
Модифицированный заряд. Такой заряд представляет собой некоторое приближение к заряду при постоянном напряжении. Его цель - немного уменьшить силу тока в начальный период заряда и понизить влияние колебания напряжения в сети на зарядный ток. Для этого последовательно с аккумуляторной батареей в электрическую цепь подключают резистор небольшого сопротивления. Такой прием известен под названием - "способ с полупостоянным напряжением". При использовании этого метода напряжение на клеммах зарядного устройства поддерживается постоянным в пределах от 2,5 до 3,0В на один аккумулятор. Считается, что для свинцовых аккумуляторов наилучшим является напряжение 2,6В на аккумулятор, обеспечивающее заряд ориентировочно за 8ч.
Постоянная подзарядка. Постоянные подзарядки наиболее применимы для стационарных аккумуляторов. Напряжение постоянной подзарядки выбирается в зависимости от конструкции аккумуляторов и срока службы с целью полной компенсации потери емкости от саморазряда. Для поддержания аккумуляторов с низким саморазрядом, лучше использовать периодические подзарядки. Режим подзарядки определяется условиями эксплуатации, типом и степенью изношенности аккумулятора. Основным недостатком режима постоянной подзарядки является параллельное протекание вторичного процесса, что способствует преждевременному ухудшению характеристик аккумуляторов.
Обычная батарея аккумуляторов говорить не умеет, она - немая, т.к. по ней очень сложно определить степени ее заряда, или ее состояние. Пользователю остается только рассчитывать, что аккумулятор отключенный от зарядного устройства исправно выполнит свои функции.
В последнее время все более широкое распространение получают так называемые разумные аккумуляторы (батареи). Внутри батареи установлен микрочип, способный обмениваться информацией с заряжающим устройством и выдавать пользователю статистические данные об аккумуляторе. Обычно такие аккумуляторные батареи применяются для питания ноутбуков, сотовых телефонов и видеокамер, а также некоторых типов оборудования медицинского и военного предназначения.
Существуют разные типы разумных аккумуляторных батарей, отличающихся количеством функций, производительностью и стоимостью. Наиболее простыми считаются аккумуляторные батареи со встроенным чипом, предназначенным для идентификации типа аккумулятора в многофункциональных зарядных устройствах, для того чтобы автоматически установить правильный алгоритм заряда. Аккумуляторные батареи со встроенной защитой от перезаряда, недозаряда и короткого замыкания, разумными называть не следует.
Наиболее совершенные разумные батареи обеспечивают определение состояния заряда. Первые чипы для разумных батарей появились в начале 90-ых годов. Сейчас их производством занимается большое число компаний. В конце 90-ых годов была разработана архитектура разумных аккумуляторных батарей с возможностью считывания степени их заряда. Это были 1- и 2-проводные системы. Большинство 2-проводных систем действует по протоколу SMBus(System Management Bus).
Аккумуляторные батареи с 1-проводным интерфейсом 1-Wire
Системы с 1-проводным интерфейсом 1-Wire принадлежат к наиболее простым, и обмен данными в них реализовывается по одному проводу. Аккумуляторная батарея со встроенной системой с 1-проводным интерфейсом 1-Wire имеет только три вывода: положительный, отрицательный и вывод информации. Некоторые производители в целях безопасности вывод датчика температуры делают отдельно (рисунок 1).
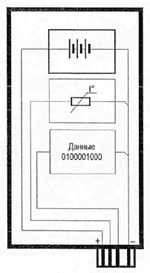
Рис.1. Схема аккумуляторной батареи с 1-проводным интерфейсом
Современные батареи с 1-проводным интерфейсом 1-Wire хранят специфические данные об аккумуляторе и отслеживают его температуру, напряжение, ток, степень заряда. Из-за простоты и относительно низкой цены они нашли широкое применение для аккумуляторов мобильных телефонов, портативных радиостанций.
Большинство аккумуляторных батарей с 1-проводным интерфейсом 1-Wire не имеют общего форм-фактора, не стандартизованы в них и способы измерения состояния аккумулятора. Все это в целом порождает проблему концепции универсального зарядного устройства. Кроме того, батареи с 1-проводным интерфейсом 1-Wire позволяют определять состояние аккумулятора только в том случае, если батарея установлена в специально разработанное под эту систему зарядное устройство.
Аккумуляторные батареи с шиной SMBus
SMBus - наиболее совершенная из всех систем, так как является стандартом для портативных электронных устройств и использует единый стандартный протокол обмена данными. SMBus представляет из себя 2-проводной интерфейс, посредством которого простые микросхемы системы электропитания могут обмениваться данными с системой. По одному проводу передаются данные, по другому - сигналы синхронизации (рисунок 2). Основу этой шины составляет архитектура шины I2C. Разработанная фирмой Philips, шина I2C представляет собой синхронную многоточечную систему двунаправленного обмена данными, действующую при частоте синхронизации 100 кГц.
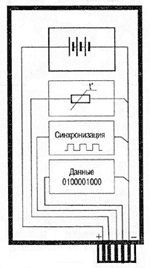
Рис.2. Схема аккумуляторной батареи с шиной SMBus
Системная архитектура разумных аккумуляторных батарей, используемая в настоящее время, была стандартизована компаниями Duracell/Intel еще в 1993 г. До этого производители портативных компьютеров разрабатывали собственные умные батареи. На основе новой спецификации был построен универсальный интерфейс, что к тому же позволило обойти отдельные препятствия, связанные с патентованной интеллектуальной собственностью.
Первые образцы аккумуляторных батарей с SMBus имели проблемы: электронные схемы не обеспечивали обработки данных с достаточной точностью, не обеспечивалось отображение как значения тока, так и значений напряжения и температуры в режиме реального времени. Было и множество других значительных проблем. В результате практически все технические решения, касающиеся реализации разумной батареи на базе SMBus, были модифицированы.
Смысл новых решений заключался в том, чтобы перенести функции управления процессом заряда с зарядного устройства на аккумуляторную батарею. Теперь уже не зарядное устройство, а сама батарея с системой на основе SMBus задавала алгоритм собственного заряда. Таким образом, обеспечивались совместимость зарядных устройств с батареями разных типов, правильная установка значений тока и алгоритма заряда, точное отсоединение батареи в момент окончания заряда. И, что важно, пользователю стало ненужным знать, аккумулятор какого типа он использует, - все эти заботы батарея брала на себя, а его функции сводились только к тому, чтобы вовремя ее заряжать.
Рассмотрим, что же такое разумная аккумуляторная батарея изнутри. Батарея с системой SMBus имеет микросхему, в которой запрограммированы постоянные и временные данные. Постоянные данные программируют на заводе-производителе, и они включают идентификационный номер батареи, сведения о ее типе, заводской номер, наименование производителя и дату выпуска. Временные данные - это те данные, которые периодически обновляются. К ним принадлежат количество циклов заряда, пользовательские данные и эксплуатационные требования.
SMBus разделяется на три уровня. Уровень 1 в настоящее время не применяется, т.к. не обеспечивает заряд различных по типу аккумуляторных батарей. Уровень 2 предназначен для внутрисхемного заряда. Пример этого - аккумуляторная батарея ноутбука, которая заряжается, будучи установленной. Уровень 3 зарезервирован для применения в многофункциональных внешних зарядных устройствах. К сожалению, из-за сложности такие зарядные устройства получаются дорогостоящими.
Аккумуляторные батареи с SMBus имеют и недостатки. Даже самые простые из них приблизительно на 25% дороже обычных аккумуляторных батарей. Несмотря на то, что разумные батареи были предназначены для того, чтобы упростить конструкцию зарядных устройств, зарядные устройства уровня 3 обходятся намного дороже зарядных устройств для обычных аккумуляторов.
Существует и еще одна проблема - необходимость калибровки. Дело в том, что в процессе использования батарея может работать при различных токах нагрузки, и ее разряд может быть неполным. При этом часто случается так, что она запоминает текущее состояние емкости, которое не соответствует истинному значению. Поэтому периодически следует переучивать батарею, для того чтобы она при установлении алгоритма заряда учитывала свою реальную емкость. Выполняется это путем выполнения цикла полного разряда с последующим полным зарядом. Периодичность такой операции - ориентировочно один раз в три месяца или через каждые 40 циклов заряд/разряд. Такой же цикл следует провести и после длительного хранения батареи, перед ее вводом в эксплуатацию.
Недостатком является и проблема несовместимости: более поздние и более совершенные версии SMBus несовместимы с более ранними вариантами.
Емкость и время работы аккумуляторных батарей очень сильно зависят от типа и качества зарядных устройств, применяемых для их заряда, которые обеспечивают определенный метод заряда и выбор режима разряда. Выбор хорошего зарядного устройства для пользователя аккумуляторов часто является вопросом второстепенной важности, особенно при использовании аккумуляторов в бытовой электронной технике. Однако это очень существенный вопрос, и решать его нужно сразу, чтобы впоследствии не удивляться, почему так быстро приходится менять аккумуляторы или почему они не держат заряд. В большинстве случаев деньги, вложенные в покупку хорошего зарядного устройства, оправдывают себя в результате эффективной работы и длительного срока службы аккумуляторов.
Построение схемы простейшего зарядного устройства зависит от принципов заряда, которых, в общем, два: ограничение тока заряда и ограничение напряжения заряда. Принцип заряда с ограничением тока заряда используется при заряде никель-кадмиевых и никель-металлгидридных аккумуляторов, а принцип с ограничением напряжения заряда - при заряде свинцово-кислотных, литий-ионных и литий-полимерных аккумуляторов.
Весьма быстрое развитие электроники, совершенствование её элементной базы привели к созданию специализированных микросхем зарядных устройств, способные автоматически обеспечить заряд аккумулятора по заданному алгоритму и предназначенные для заряда аккумуляторов любого типа. Кроме того, отдельные типы микросхем помимо заряда обеспечивают измерение емкости аккумулятора или аккумуляторной батареи и степени разряда.
Современные микросхемы зарядных устройств способны очень четкое прекращать процесса заряда практически по всем возможным характеристикам заряда: по скорости повышения температуры ?Т/?t, по пиковому напряжению на аккумуляторной батарее, по кратковременному понижению напряжения ?U/?t, по максимальной температуре, по сигналу таймера. Отдельные микросхемы обеспечивают контроль температуры окружающей среды и в зависимости от этого корректируют режим заряда и разряда. Например, такая коррекция происходит пошагово при изменении температуры на каждые 10 °С в пределах от -35 до +85 °С. На практике любая из этих схем, взятая за основу, обрастает дополнительными элементами, добавляющими зарядному устройству новые возможности, улучшая его характеристики.
Зарядные устройства аккумуляторов, обеспечивающие постоянный ток (гальваностатический режим заряда)
Большая часть зарядных устройств обеспечивает заряд только постоянным током и потому пригодны лишь для заряда щелочных герметичных аккумуляторов (никель-металлгидридных и никель-кадмиевых). Простейшие бытовые зарядные устройства, осуществляющие заряд постоянным током, применяются для заряда от 1 до 4 аккумуляторов. Они различаются в основном конструкцией, а не принципиальной электрической схемой. Чаще всего такие зарядные устройства питаются через трансформатор от сети 220В и обеспечивают выпрямленный ток с невысоким уровнем его стабилизации. Ток практически всегда не регулируется, а время заряда определяется самим пользователем.
Универсальность бытовых зарядных устройств, как правило, означает возможность установки в них аккумуляторов разных габаритов и обеспечение постоянного тока порядка 0,1С, по отношению к емкости, которую производитель зарядного устройства считает типичной для аккумуляторов такого типоразмера. Поэтому следует быть внимательным при установке в них аккумуляторов и правильно определять время заряда. За последние 5-7 лет быстрый прогресс промышленности привел к выпуску щелочных аккумуляторов одинаковых габаритов, но отличающихся по емкости в 3 раза. Стремление использовать простые универсальные зарядные устройства для заряда аккумуляторов все большей емкости может привести к очень продолжительному и, главное, малоэффективному заряду токами существенно меньше стандартного значения. Главным достоинством таких зарядных устройств является их низкая цена.
Более дорогие зарядные устройства обеспечивают несколько режимов: доразряд (если он необходим), заряд и режим подзаряда. Доразряд щелочных аккумуляторов (до 1 В/ак) производится с целью снятия остаточной емкости. Однако следует учитывать, что в таких зарядных устройствах аккумуляторы, устанавливаемые в пружинные контакты, могут быть соединены последовательно, а контроль разряда выполняется по предельному разрядному напряжению U=(n х 1,0)В, где n - количество аккумуляторов в цепочке. Но после длительной эксплуатации аккумуляторы могут очень сильно различаться по емкости, и контроль по среднему напряжению для всей цепочки может привести к переразряду или переполюсованию наиболее слабых и их порче.
Прекращение заряда или переключение в режим подзаряда (малым током для компенсации саморазряда) производится в таких зарядных устройствах автоматически в соответствии с некоторыми из тех параметров контроля, которые описаны в другой статье. При использовании таких зарядных устройств следует помнить, что не рекомендуется часто и надолго оставлять аккумуляторы в режиме компенсационного подзаряда, так как это укорачивает срок их службы.
Некоторые зарядные устройства конструктивно оформлены так, что обеспечивают заряд как 1-4 отдельных аккумуляторов, так и 9 В батареи типоразмера 6E22 (E-BLOCK). Некоторые зарядные устройства имеют индивидуальный контроль процесса заряда (детекция -?U) в каждом канале, что дает возможность заряжать одновременно аккумуляторы разных типоразмеров.
Следует заметить, что в том случае, когда пользователь может позволить себе длительный заряд никель-кадмиевых или никель-металлгидридных аккумуляторов стандартным током 0,1 С в течение 16 ч, можно использовать простейшие зарядные устройства с контролем процесса по времени. При этом, если нет уверенности в полном исчерпании емкости, следует очередной заряд сократить по времени: лучше некоторый недозаряд аккумуляторов, чем значительный перезаряд, который может привести к их деградации и преждевременном выходе из строя. Но вообще большая часть современных цилиндрических аккумуляторов может перенести случайный довольно значительный перезаряд без повреждения и последствий, хотя емкость их при последующем разряде и не повысится.
Если же нужно максимально сократить время переподготовки аккумуляторов после исчерпания емкости, следует использовать зарядные устройства для быстрого заряда, но с высоким уровнем контроля процесса. При выборе зарядного устройства с разными параметрами контроля процесса следует учитывать, что контроль его по абсолютной величине конечного напряжения ненадежен, а из двух наиболее часто рекомендуемых производителями аккумуляторов параметров (-?U и ?T/?t) первый реализован уже во многих современных зарядных устройствах, второй - для обычных зарядных устройств редок, прежде всего из-за того, что требует наличия термодатчика, а его устанавливают только в батареях, но возможна установка термодатчика в место контакта аккумулятора с зарядным устройством. Не следует увлекаться и чересчур быстрым зарядом аккумуляторов (некоторые компании предлагают заряд за 15-30 мин). При плохом аппаратурном обеспечении даже надежного способа контроля заряда, столь быстрый заряд значительно сократит срок службы аккумулятора.
Зарядные устройства аккумуляторов, обеспечивающие режим постоянного напряжения (потенциостатический режим заряда) и комбинированный заряд
Зарядные устройства для свинцово-кислотных, литий-ионных и литий-полимерных аккумуляторных батарей должны осуществлять стабилизацию тока на первой стадии заряда и стабилизацию напряжения питания на второй. Кроме того, должен быть обеспечен контроль конца заряда, который в общем случае может выполняться либо по времени, либо по снижению тока до заданной минимальной величины.
Зарядных устройств с такой стратегией заряда на рынке много меньше, чем зарядных устройств, реализующих режим постоянного тока (имеются ввиду зарядные устройства для непосредственного заряда аккумуляторов и батарей, а не блоки питания для сотовых телефонов, ноутбуков и т.п.).
О зарядных устройствах никель-кадмиевых и никель-металлгидридных аккумуляторах
Для никель-кадмиевых и никель-металлгидридных аккумуляторных батарей существует три типа зарядных устройств. К ним относятся:
1. Зарядные устройства нормального (медленного) заряда
2. Зарядные устройства быстрого заряда
3. Зарядные устройства скоростного заряда
1. Зарядные устройства нормального (медленного) заряда. Зарядные устройства этого типа, иногда называют ночными. Ток нормального заряда составляет 0,1С. Время заряда - 14...16 ч. При таком малом токе заряда трудно определить время окончания заряда. Поэтому обычно индикатор готовности батареи в зарядных устройствах для нормального заряда отсутствует. Они самые дешевые и предназначены только для зарядки никель-кадмиевых аккумуляторов. Для зарядки как никель-кадмиевых так и никель-металлгидридных аккумуляторов используются другие, более совершенные зарядные устройства. Если зарядный ток установлен правильно, полностью заряженная батарея становится чуть теплой на ощупь. В таком случае нет надобности немедленно отключать ее от зарядного устройства. В нем она может оставаться более чем на один день. Но все же ее отсоединение сразу после окончания заряда - лучший вариант. При применении таких зарядных устройствах проблемы возникают, если они используются для зарядки батарей малой емкости, в то время как рассчитаны для работы с более мощными батареями. В таком случае аккумуляторная батарея станет нагреваться уже по достижении 70% своей емкости. Поскольку возможность понизить ток заряда или прекратить его процесс вообще отсутствует, то во второй половине цикла заряда начнется процесс теплового разрушения аккумуляторов. Единственно возможный способ сохранить аккумуляторы, это отключить их, как только они станут горячими. В случае, если для зарядки мощной аккумуляторной батареи используется недостаточно мощное зарядное устройство, батарея в процессе заряда будет оставаться холодной и никогда не будет заряжена до конца. Тогда она потеряет часть своей емкости.
2. Зарядные устройства быстрого заряда. Они позиционируются как зарядные устройства среднего класса как по скорости заряда, так и по цене. Заряд аккумуляторов в них происходит в течение 3...6 часов током около 0,ЗС. В качестве необходимого элемента эти зарядные устройства имеют схему контроля достижения аккумуляторами определенного напряжения в конце заряда и их отключения в этот момент. Такие зарядные устройства обеспечивают лучшее по сравнению с устройствами медленного заряда обслуживание аккумуляторов. В настоящее время они уступили свое место зарядным устройствам скоростного заряда.
3. Зарядные устройства скоростного заряда. Такие зарядные устройства имеют несколько преимуществ перед зарядными устройствами других типов. Главное из них - меньшее время заряда. Хотя из-за большей мощности источника напряжения и необходимости использования специальных узлов контроля и управления такие зарядные устройства имеют наиболее высокие цены. Время заряда в зарядных устройствах такого типа зависит от тока заряда, степени разряда аккумуляторов, их емкости и типа. При токе заряда 1С разряженная никель-кадмиевая батарея заряжается в среднем менее чем за один час. Если же аккумуляторная батарея полностью заряжена, некоторые зарядные устройства переходят в режим подзарядки пониженным током заряда и с отключением по сигналу таймера.
Современные устройства скоростного заряда обычно используются для зарядки как никель-кадмиевых, так и никель-металлгидридных аккумуляторных батарей. Поскольку этот процесс происходит при повышенном токе заряда и за ним необходим контроль, крайне важно, чтобы в конкретном зарядном устройстве заряжались только те аккумуляторы, которые рекомендованы для скоростного заряда производителем. Некоторые батареи маркируют электрически на заводах-изготовителях с той целью, чтобы зарядное устройство могло распознать их тип и основные электрические характеристики. После этого зарядное устройство автоматически установит величину тока и задаст алгоритм процесса заряда, соответствующие установленным в него аккумуляторам.
Еще раз подчеркнем, что свинцово-кислотные и литий-ионные аккумуляторные батареи имеют алгоритмы заряда, не совместимые с алгоритмом заряда никель-кадмиевых и никель-металлгидридных аккумуляторов.
Основная проблема, которая возникает при заряде аккумуляторов, состоит в поиске параметра, измерения которого позволили бы с достаточной точностью определить состояние полного заряда.
В ходе заряда герметичных щелочных аккумуляторов меняется несколько параметров: напряжение, температура, внутреннее давление. Характер их изменений в процессе заряда герметичного никель-кадмиевого аккумулятора изображен на рисунке 1. Эти параметры обеспечивают различную чувствительность и имеют разные ограничения при использовании. Характер изменения указанных параметров у никель-металлгидридных аккумуляторов похож, но они более чувствительны к перегреву при перезаряде.
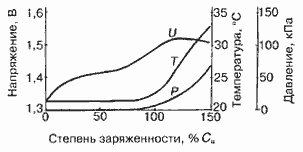
Рис.1. Изменение характеристик герметичного никель-кадмиевого аккумулятора при заряде
Заряд стандартным режимом обычно проводится в течение регламентированного времени. Контроль напряжения при такой стратегии заряда малоэффективен, так как при низких плотностях тока заряда напряжение в конце процесса (Uкон) меняется незначительно и контроль процесса по его величине, выбранной в соответствии с рекомендованной производителем как типичной для данного типа источника тока, может привести к недозаряду одних и перезаряду других аккумуляторов (в зависимости от их индивидуальных зарядных характеристик). Паспортная величина конечного напряжения паказывает только статистический параметр, а разброс его у аккумуляторов в партии может быть заметным. К тому же величина эта зависит от температуры и наработки аккумулятора.
При быстром заряде использование напряжения в качестве контрольного параметра оказалось более результативным. Это определяется изменением вида зарядной кривой. В этом случае нет надобности ориентироваться на конкретную величину предельного зарядного напряжения, нужно лишь установить момент достижения его максимальной величины. Для этого устройствами контроля периодически определяется величина dU/dt или d2U/dt2. Максимум зарядного напряжения наблюдается как правило при заряде до 110-120 % Сн.
В случаи прекращения заряда в этот момент, при последующем разряде в стандартном режиме удается снять около 95% номинальной емкости. Для обеспечения большего перезаряда (до 140-160 %) нужно либо необходимое время сохранять заряд тем же током, либо обеспечить переход к более безопасному режиму подзаряда меньшим током.
В настоящее время для контроля хода быстрого заряда чаще используется другой критерий: прерывание заряда производят после того, как напряжение аккумулятора уменьшится на ?U после достижения максимума. Это обеспечивает нужный уровень перезаряда аккумуляторов.
Такой контроль рекомендуется для быстрого заряда (в течение 1 ч) цилиндрических щелочных рулонных аккумуляторов, если изготовитель разрешает такой заряд для конкретного типа аккумуляторов. В литературе он называется детекцией -?U. Величина -?U для аккумуляторов разных производителей может составлять от 5-10 до 10-20 мВ, Для контроля заряда чаще предлагается использовать величину 10 мВ/аккумулятор при температуре заряда от 0 до 30 °С. При этом в начале заряда (в течение 5-10 мин) рекомендуется не проводить измерения напряжения источника тока во избежание срабатывания системы контроля из-за возможного скачка напряжения (и последующего его небольшого спада) после длительного хранения.
Другим параметром, который применяется при контроле заряда современных герметичных щелочных аккумуляторов, является температура. Контроль температуры более всего нужен при заряде никелъ-металлгидридных аккумуляторов. Температурный датчик устанавливается не на каждом аккумуляторе, а на одном из них в батарее. Понятно, что влияние конструктивных особенностей батареи и реализуемых в ней условий теплообмена делают контроль заряда по абсолютной величине температуры Т весьма проблематичным, так как непросто однозначно определить величину этого параметра. Специалисты компании GP, например, детально исследовали процесс заряда батареи емкостью 2,5 Ач током 0,5 С при температуре окружающей среды (Tокр) от 15 до 45 °С. Изучалось отключение при температуре батареи (Tбат), равной 55 и 60 °С. Было показано, что если температура окружающей среды выше 35 °С, то при Tбат = 55 °С имеет место существенный недозаряд. При Tбат=60 °С недозаряд несколько уменьшается. Увеличивать еще больше значение контролируемого параметра (Tбат > 60 °C) нельзя без риска увеличения опасности отказа аккумулятора.
Все производители как правило рекомендуют максимальную величину температуры при быстром заряде - не более 55 °С. Следует понимать, что при повышенных температурах окружающей среды избежать недозаряда при таком способе контроля зарядного процесса не получится. Более рациональным является контроль другого параметра: скорости изменения температуры (?T/?t), что позволяет при любой температуре окружающей среды диагностировать интенсификацию побочных процессов, которая имеет место при перезаряде. Величина ?T/?t, при которой различные производители рекомендуют отключать герметичные щелочные аккумуляторы, находится в интервале от 1 до 2 °С/мин при токе заряда 1С и 0,8 °С/мин, если ток меньше.
Большая часть производителей полагает, что наилучшие результаты достигаются при контроле заряда по двум критериям (оценка -?U и ?T/?t) одновременно. Такой метод контроля универсален как для аккумуляторов разных типов, так и для разного уровня их заряженности. Следует заметить, что второй из этих параметров обеспечивает более благоприятные условия работы аккумуляторов при длительной эксплуатации.
Найден еще один электрический параметр, который по величине значительно больше изменений напряжения. Этот параметр - реакция источника тока на тестовый сигнал переменного тока.
Для контроля степени заряженности свинцово-кислотных аккумуляторов можно использовать напряжение разомкнутой цепи, которое меняется от 2,05-2,15В/ак при заряженном состоянии (в зависимости от концентрации кислоты) до 1,95-2,03 В/ак после полного разряда. Эта зависимость показана на рисунке 2.
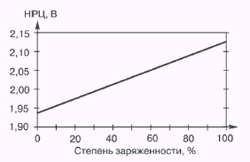
Рис.2. Зависимость напряжения разомкнутой цепи свинцово-кислотного аккумулятора от уровня заряженности
При контроле заряженности свинцово-кислотного аккумулятора в ходе заряда, заряд считается завершенным если ток заряда (при неизменном стандартном напряжении заряда) остается неизменным в течении 3-х часов.
При заряде литий-ионных аккумуляторов ориентируются также на напряжение аккумулятора. В начальный период, когда только появились литий-ионные аккумуляторные батареи, использующие графитовую систему, требовалось ограничение напряжения заряда из расчета 4,1 В на элемент. В настоящее время литий-ионные элементы можно заряжать до напряжения 4,20 В. Допустимое отклонение напряжения составляет всего лишь около ±0,05 В на элемент. Рисунок 3 отображает стандартный процесс заряда литий-ионного аккумулятора.
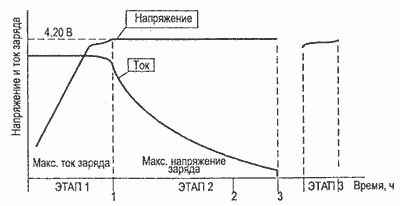
Рис.3. Зависимость напряжения и тока от времени при заряде литий-ионного аккумулятора
ЭТАП 1 - Через аккумулятор протекает максимально допустимый ток заряда, пока напряжение на нем не достигнет порогового значения.
ЭТАП 2 - Максимальное напряжение на аккумуляторе достигнуто, ток заряда постепенно снижается до тех пор пока он полностью не зарядится. Момент завершения заряда наступает когда величина тока заряда снизится до значения 3% от начального.
ЭТАП 3 - Периодический компенсирующий заряд, проводящийся при хранения аккумулятора, ориентировочно через каждые 500 часов хранения.
При эксплуатации герметичного Ni-Cd аккумулятора отмечается феномен, который долгие годы вызывал беспокойство пользователей этих источников тока. Феномен получил название - эффект памяти.
Первоначально его наблюдали при специфических режимах циклирования - с малой глубиной разряда (не более 30% от состояния полной заряженности) аккумулятора. В результате такой эксплуатации на разрядной кривой аккумулятора возникала вторая площадка более низкого напряжения, и емкость, которую можно было снять до момента достижения 1В, понижалась. При увеличении продолжительности циклирования в этом режиме площадка пониженного напряжения увеличивалась (сдвигалась влево).
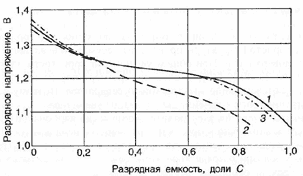
Впоследствии любое уменьшение разрядного напряжения, наблюдаемое при длительном циклировании на небольшую глубину, стали называть "эффектом памяти", хотя механизмы, приводящие к такому эффекту, могли различаться. Так как вопрос об "эффекте памяти" возникает у большинства потребителей источников тока разных систем, мы хотим обратить особое внимание на различие этих механизмов, приводящих к снижению напряжения аккумулятора.
В герметичных Ni-Cd аккумуляторах кадмиевый электрод имеет никелевую основу. Кроме того, в его активной массе присутствует некоторое количество оксидов никеля, которые входят в рецептуру или попадают в электрод в ходе технологического процесса его производства. При циклировании аккумуляторов в кадмиевом электроде может образоваться интерметаллическое соединение Ni5Cd21 разряд которого совершается при потенциале на 150 мВ положительнее, чем разряд чистого кадмиевого электрода. В результате этого на разрядной кривой Ni-Cd аккумулятора и появляется вторая площадка с более низким напряжением. Формирование этой площадки идет наиболее быстро при небольших токах заряда и ускоряется с повышением температуры. Именно такая ситуация часто имеет место при использовании источников тока в буферном режиме. Неглубокое циклирование на верхнем уровне заряженности приводит к повышенному тепловыделению аккумулятора и быстрому росту содержания Ni5Cd21.
Уменьшение разрядного напряжения в результате накопления никелата кадмия не является необратимым. Разрушение Ni5Cd21 и восстановление начального состояния активной массы происходит при проведении нескольких разрядов до 1В, которые следует делать не реже 1 раза в месяц.
Если аккумулятор используется в режиме глубокого циклирования, этот эффект вообще не возникает.
Имеет место и другой механизм, который приводит к снижению разрядного напряжения, хоть и меньшему по величине по сравнению с описанным выше. Он связан с регулярными значительными перезарядами аккумуляторов. На оксидно-никелевом электроде в этом случае образуется ?-фаза NiOOH, разрядный потенциал которого ниже на 50 мВ, чем у ?-NiOOH. И разрядное напряжение аккумулятора понижается. Эффект снижения разрядного напряжения аккумуляторов, связанный с действием их перезаряда, можно назвать ложным эффектом памяти.
Для того чтобы такой эффект не возникал, достаточно просто правильно контролировать заряд и не допускать продолжительных перезарядов, особенно при больших токах.
Следует добавить, что перезаряд к тому же способствует формированию крупных кристаллов в структуре электродов. Их рабочая поверхность уменьшается, и это ведет к уменьшению разрядной емкости. Укрупнение кристаллов в электродных массах происходит и при малых токах, которые имеют место в режиме компенсационного подзаряда. Поэтому долго держать аккумуляторы в таком режиме не рекомендуется.
При периодическом проведении разрядов никель-кадмиевых аккумуляторов до 1В происходит перестройка структуры активных масс. Возвращение мелкопористой структуры приводит к увеличению рабочей поверхности электродов и повышению разрядной емкости аккумулятора. Еще больший эффект разукрупнения кристаллов достигается при последующем доразряде до 0,5В малыми токами, а также при циклировании с зарядом знакопеременным током.
Но не стоит забывать что уменьшение емкости аккумуляторов происходит и в результате процессов деградации, которые происходят даже в не использующихся аккумуляторах.
Развитие первичных химических источников тока. В 1800 г. итальянский ученый А. Вольта сообщил о создании батареи первичных элементов, получившей название "вольтов столб". Открытие А. Вольта оказало большое влияние на развитие электротехники. Начало промышленного производства первичных химических источников тока было заложено в 1865 г. французом Ж. Л. Лекланше, предложившим марганцево-цинковый элемент с солевым электролитом. В 1880 г. Ф. Лаландом был создан марганцево-цинковый элемент с загущенным электролитом. Впоследствии этот элемент был значительно улучшен. Существенное улучшение характеристик было получено при применении электролитического диоксида марганца на катоде и хлорида цинка в электролите. До 1940 г. марганцево-цинковый солевой элемент был практически единственным используемым первичным химическим источником тока. Несмотря на появление в дальнейшем других первичных источников тока с более высокими характеристиками, марганцево-цинковый солевой элемент используется в очень широких масштабах, в значительной мере благодаря его относительно невысокой цене.
В 50-х годах XX в, на рынке появились марганцево-цинковые источники тока с щелочным электролитом, характеристики которых существенно лучше солевых батареек, а за последние годы они значительно улучшились. Суммарный выпуск и доля щелочных марганцево-цинковых батареек в общем производстве первичных химических источников тока непрерывно увеличиваются. Выпуск их в 2001 г. составил примерно 28 млрд шт., что составляет 61% выпуска всех первичных источников тока. Суммарный выпуск марганцево-цинковых источников тока в 2001 г. - примерно 46 млрд шт., что составляет 90% штучного выпуска всех химических источников тока.
В 40-х годах XX в. началось производство серебряно-цинковых, в 50-х - ртутно-цинковых, а в 60-х - воздушно-цинковых источников тока. В конце 60-х и начале 70-х годов было организовано изготовление первичных литиевых источников тока, удельная энергия которых значительно выше удельной энергии других первичных химических источников тока (ХИТ), за исключением воздушно-цинковых. Объем производства и доля литиевых источников тока в совокупном выпуске первичных ХИТ быстро возрастают.
Типы и характеристики основных первичных Химических Источников Тока
Как уже указывалось выше, к наиболее распространенным относятся марганцево-цинковые и литиевые первичные источники тока. Другие источники тока производятся в значительно меньших масштабах. Вкратце опишем основные первичные химические источники тока и их характеристики.
Марганцево-цинковые источники тока с солевым электролитом. Анодом служит цинк, являющийся корпусом источника тока, активным веществом катода - электролитический диоксид марганца или химический диоксид марганца, электролитом - хлорид аммония, хлорид цинка или хлорид аммония с хлоридом цинка. Электролит находится либо в загущенном состоянии, либо в порах микропористого сепаратора. Для снижения скорости или предотвращения коррозии в цинк и в электролит добавляют ингибиторы коррозии. К достоинствам этих батареек относятся невысокая стоимость и большое количество выпускаемых типоразмеров, к недостаткам - падающая разрядная кривая, относительно невысокая удельная энергия, значительное ухудшение характеристик при повышенных нагрузках и низких температурах. Батарейки солевые и щелочные
Марганцево-цинковые источники тока с щелочным электролитом. Анодом служит порошкообразный цинк, а катодом - диоксид марганца. Электролитом является гелеобразный раствор КОН или КОН в матрице. В состав анода и электролита включают ингибиторы коррозии. В сравнении с марганцево-цинковым источником тока с солевым электролитом батарейки с щелочным электролитом имеют более высокие емкость и удельную энергию, в особенности при повышенных нагрузках и низкой температуре, но они более дорогие. Батарейки солевые и щелочные
Ртутно-цинковые источники тока. Анодом является порошкообразный цинк, катодом - оксид ртути, электролитом - раствор КОН. Характеризуется горизонтальной разрядной кривой, высокой удельной энергией, низким саморазрядом. К недостаткам относятся плохие характеристики при пониженных температурах, высокая стоимость и, самое главное, высокая токсичность ртути. Применялись в медицинских устройствах, точных приборах и других устройствах. В последние годы из-за токсичности ртути в некоторых странах выпуск прекращен, в других странах существенно сокращен.
Ртутно-кадмиевые источники тока. Анодом служит порошкообразный кадмий, катодом - оксид ртути, электролитом - раствор КОН. Рабочие температуры окружающей среды от -55 до 80 °С. Они имеет горизонтальную разрядную кривую, очень низкий саморазряд, что обеспечивает сохранность заряда до 10 лет. Даже при температуре 60 °С саморазряд не превышает 1% в месяц. К недостаткам относятся токсичность и высокая цена компонентов. Изготавливаются в ограниченных масштабах в дисковой, цилиндрической и призматической формах. Применяются в устройствах контроля бурения нефтяных и газовых скважин, телеметрии двигателей внутреннего сгорания, сигнальных устройствах тревоги, спасательном-оборудовании, устройствах мониторинга в отдаленных районах и т.д. Из-за токсичности производство этих источников тока сокращается.
Серебряно-цинковые первичные источники тока. В качестве анода применяется порошкообразный цинк, катода - оксиды серебра, электролита - раствор КОН или NaОН (загущенные или матричные). Имеют гладкую разрядную кривую, высокую удельную энергию, низкий саморазряд, могут работать при больших токах, однако дороги. Производятся в дисковой форме емкостью до 200 мА·ч. Применяются в часах, фотоаппаратах, слуховых аппаратах и других устройствах.
Медно-цинковые источники тока. Производство этих химических источников тока началось еще в 1889 г. В настоящее время они выпускаются в небольших масштабах в виде элементов емкостью от 250 до 1000 А·ч. Гладкие цинковые пластины и пластины из смеси оксида меди, меди и связующего помещают в стеклянный или металлический сосуд с 20%-ным раствором NaОН. Элементы имеют напряжение 0,6-0,7 В и удельную энергию 25-30 Вт·ч/кг. К их достоинствам относится постоянство разрядного напряжения, очень малый саморазряд, безотказность в работе и невысокая цена. Применялись в системах сигнализации и связи на железных дорогах.
Воздушно-цинковые первичные источники тока. Активным веществом катода служит кислород воздуха, поэтому катод является нерасходуемым, он содержит катализатор восстановления кислорода (активированный уголь или диоксид марганца). В качестве электролита применяется раствор КОН. К достоинствам источника тока относятся очень высокая удельная энергия и относительно невысокая цена, к недостаткам - влияние окружающей среды (влажности воздуха и диоксида углерода) на характеристики источника тока. Производятся две разновидности: призматические с высокой емкостью (до 1000 А·ч) и дисковые с малой емкостью. Используются для питания средств связи, в слуховых аппаратах, медицинских и других устройствах.
Литиевые первичные источники тока с твердыми катодами и апротонным электролитом. Восстановителем является литий, окислителями - оксиды, сульфиды металлов или фтороуглерод. Электролитами служат растворы солей лития (LiClO4, LiBF4 или LiBr) в апротонных растворителях: пропиленкарбонате (ПК), диоксолане (ДОЛ), ?-бутиролактоне (БЛ), тетрагидрофуране (ТГФ), диметоксиэтане (ДМЭ) и др. В зависимости от типа используемого окислителя источник тока имеет разрядное напряжение около 1,5В (CuO, CuS, FeS, Bi2O3 или FeS2) или 2,5-3,2В (MnO2, (CF)n, Ag2V4O11, Ag2CrO4, Cu4O(PO4)2 и др.). Литиевые первичные источники тока имеют более высокую емкость и удельную энергию, более широкий интервал рабочих температур, лучшую работоспособность при пониженных температурах и меньшую скорость саморазряда по сравнению с этими же параметрами марганцево-цинковых источников тока. Однако они дороже марганцево-цинковых элементов. Литиевые источники тока с напряжением 1,5В заменяют марганцево-цинковые батарейки одинакового типоразмера, источники тока с напряжением 2,5-3,2В заменяют батареи марганцево-цинковых элементов. Они используются в медицинской, бытовой, промышленной и военной электронике. Литиевые Батарейки
Литиевые источники тока с жидким или растворенным окислителем. В этих источниках тока используются диоксид серы (SO2), растворяющийся в органическом растворителе, жидкие тионилхлорид (SOCl2) и сульфурилхлорид (SO2Cl2). Катоды в источнике тока нерастворимые и изготавливаются из углеродистых материалов, нанесенных на алюминиевую (для SO2), никелевую основу или нержавеющую сталь. Электролитом в элементе системы литий - диоксид серы является LiBr, растворенный в ацетонитриле, в элементах с тионилхлоридом и сульфурилхлоридом - LiAlCl4 в SOCl2 или в SO2Cl2 с добавками. Эти источники тока имеют очень высокую удельную энергию, высокие скорости разряда и удельную мощность, горизонтальную разрядную кривую, способность функционировать при низких температурах (до -55 °С), длительный ресурс. К недостаткам следует отнести сравнительно высокую стоимость, работу под давлением, потенциальную взрывоопасность, присутствие токсичных компонентов. Используются в тех областях, где требуются высокие удельная энергия и мощность, длительная сохранность, способность работать при низких температурах (в космической и военной технике, системах сохранения памяти, и других устройствах). Литиевые Батарейки
Йодно-литиевые источники тока с твердым электролитом. Окислителем является йод, растворенный в твердом поливинилпиридине (ПВП), электролитом - твердая соль LiI, толщина которой непрерывно возрастает в результате токообразующей реакции. Эти источники тока могут храниться очень продолжительное время, имеют высокую удельную энергию, широкий диапазон рабочих температур, но очень низкие скорость разряда и удельную мощность. Используются в основном в кардиостимуляторах и производятся для этих целей в специальной D-образной форме. Литиевые Батарейки
Параметры первичных химических источников тока
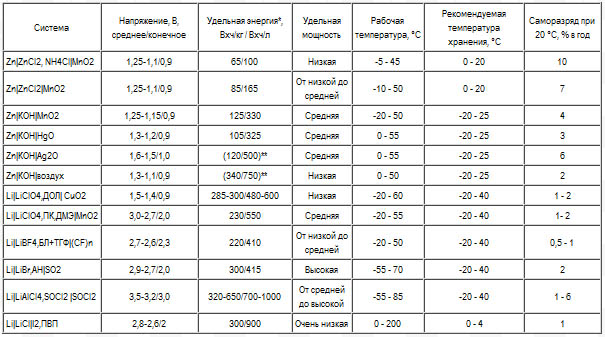
* - для цилиндрических элементов
** - для дисковых элементов
Сравнение характеристик первичных химических источников тока. Разрядное напряжение первичных источников тока лежит в диапазоне 1,1-3,5 В (см. рисунок). Практически горизонтальную разрядную кривую имеют воздушно-цинковые, оксидносерно-литиевые и тионилхлоридно-литиевые источники тока, т.е. элементы с не расходуемым катодом. У остальных первичных источников тока, за исключением серебряно-цинковых (с Ag2O), напряжение при разряде заметно понижается (см. рисунок), в особенности при высоких скоростях разряда. С понижением температуры напряжение источников тока падает. Кривая зависимости удельной энергии от рабочей температуры проходит через максимум (см. рисунок). Такую же зависимость имеет и емкость. При отрицательных температурах резко уменьшаются электрические характеристики марганцево-цинковых источников тока с солевым электролитом, воздушно-цинковых, серебряно-цинковых и ртутно-цинковых источников тока, поэтому рекомендуемые для них рабочие температуры находятся выше 0 °С. Наиболее высокие удельные энергии при комнатной температуре имеют воздушно-цинковые и тионилхлоридно-литиевые источники тока, наименьшие значения удельной энергии - медно-цинковые элементы. Высокие удельные мощности характерны для источников систем диоксид серы-литий, тионилхлорид-литий и оксид серебра-цинк. Минимальный саморазряд отмечается у литиевых источников питания с твердыми восстановителями, литиевых источниках с твердым электролитом и ртутно-кадмиевых источниках питания, максимальный саморазряд - у марганцево-цинковых источниках тока с солевым электролитом (см. рисунок). По стоимости первичные источники можно выстроить в следующий ряд: Zn|NH4Cl|MnO2 < Zn/воздух < Zn|КОН|MnO2 < Li/MnO2 < Li/SOCl2 < Li/SO2 < Ag2O/Zn < Li/I2. Однако по удельной стоимости (на единицу запасенной энергии) источники питания будут располагаться в другой ряд: Zn/воздух < Zn|NH4Cl|MnO2 < Li/SOCl2 < Zn|КОН|MnO2 < Li/SO2 < Li/MnO2 < Li/I2 < Ag2O/Zn.
Приведенные ряды имеют оценочный характер. Реальная стоимость зависит от типоразмера и формы источника питания, объема производства и прочих факторов.
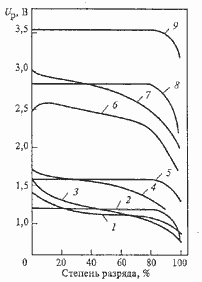
Разрядные кривые источников тока при 20 °С:
1- Zn|NH4Cl|MnO2, 2- Zn/воздух, 3-Zn|КОН|МnО2, 4-Li/FeS2, 5- Zn/Ag2O, 6- Li/(CF)n, 7- Li/MnO2, 8- Li/SO2, 9- Li/SOCl2
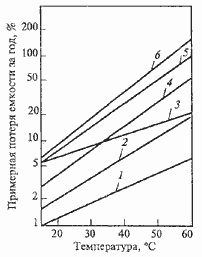
Зависимость потери емкости источников тока от температуры:
1-Li/MnO2, 2-Li/SO2, 3-Li/SOCl2, 4-Zn|КОН|МnО2, 5-Zn/Ag2O, 6-Zn|NH4Cl|MnO2
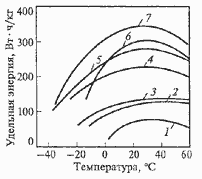
Зависимость массовой удельной энергии источников тока от температуры:
1- Zn|NH4Cl|MnO2, 2- Zn|КОН|МnО2, 3-Zn/Ag2O, 4-Li/MnO2, 5-Li/SO2, 6-Zn/воздух, 7- Li/SOCl2
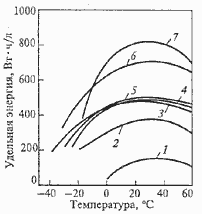
Зависимость объемной удельной энергии источников тока от температуры:
1- Zn|NH4Cl|MnO2, 2- Zn|КОН|МnО2, 3-Li/SO2, 4-Zn/Ag2O, 5-Li/MnO2, 6-Li/SOCl2, 7-Zn/воздух
Марганцево-цинковые батарейки выпускаются в двух вариантах: с солевым и щелочным электролитом.
Солевые батарейки
До недавнего времени элементы этой электрохимической системы являлись наиболее распространенными несмотря на то, что появились они одними из первых и сохранились практически в неизмененном виде благодаря своим характеристикам:
для производителя:
- дешевизна и доступность сырья
- простота технологии производства
для покупателя:
- низкая конечная стоимость, определенная низкими затратами производителя;
- удобство использования;
- удовлетворительные для большинства облостей применения электрические параметры.
Именно соотношение цены и качества дало возможность им почти полтора века удерживать пальму первенства. Но все-таки в последнее время многие производители неуклонно сокращают их производство или полностью отказываются от их выпуска, что объясняется повышением требований производителей современного электронного оборудования к электрическим параметрам источников питания.
К числу недостатков солевых батареек относятся:
- резкое падение напряжения в течении разряда;
- значительное снижение отдаваемой емкости при увеличении разрядных токов до значений, необходимых для современных устройств;
- резкое ухудшение характеристик при отрицательных температурах;
- маленький срок хранения (порядка двух лет).
Понятие "номинальная емкость" редко употребляется для характеристики марганцево-цинковых батареек, так как их емкость сильно зависит от режимов и условий эксплуатации.
Основными недостатками этих элементов являются значительная скорость снижения напряжения на всем протяжении разряда и значительное уменьшение отдаваемой емкости при увеличении тока разряда. Конечное разрядное напряжение устанавливают в зависимости от нагрузки в интервале 0,7-1,0 В.
Важна не только величина тока разряда, но и временной график нагрузки. При прерывистом разряде большими и средними токами работоспособность батареек заметно увеличивается по сравнению с непрерывным режимом работы. Однако при малых разрядных токах и многомесячных перерывах в работе емкость их может снижаться в следствии саморазряда.
Элементы работоспособны в интервале температур от -20 до +60 °С. При длительном воздействии высокой температуры увеличивается саморазряд элементов. А при низкой температуре заметно уменьшается отдаваемая емкость. Но при корректировке рецептуры электролита выпускается серия хладостойких батареек, работоспособных в диапазоне температур от -40 до +40 °С.
На работоспособность солевых марганцево-цинковых элементов существенно сказывается время их хранения с момента изготовления. Саморазряд их определяется, главным образом, коррозией цинкового электрода, а также взаимодействием активных масс положительного электрода с загустителями электролита. В зависимости от рецептур активных масс и электролита, конструктивного исполнения и размеров элементов их сохранность колеблется от 1 года до 3 лет. К концу гарантированного срока утрата емкости может составлять 30-40 %.
При использовании в устройствах, у элементов на последней стадии разряда и по его окончании может произойти течь электролита, что связано с повышением объема активной массы положительного электрода и выдавливанием электролита из его пор. Особенно сильно этот эффект проявляется после разряда большими токами или короткого замыкания. В конце разряда в результате медленного разложения диоксида марганца может также выделяться кислород, а в результате коррозии цинка - водород, что тоже способствует увеличению внутреннего объема батарейки.
Электроды и электролит. Активная масса положительного электрода (называющаяся "агломерат") состоит из смеси диоксида марганца с чешуйчатым графитом либо ацетиленовой сажей и электролитом. При этом технология изготовления MnO2 заметно сказывается на электрических характеристиках элементов. Графит и сажа увеличивают электрическую проводимость активной смеси. Их массовая доля составляет 8-20% в зависимости от назначения источника тока. Чем выше разрядные токи, на которые рассчитан марганцево-цинковый элемент, тем выше содержание токопроводящих добавок. Для повышения степени использования окислителя активную массу пропитывают раствором электролита.
Отрицательный электрод изготовляется из коррозионно-стойкого цинка высокой степени чистоты (массовая доля цинка 99,94% и более). Цинк содержит маленькое количество свинца, галлия или кадмия (десятые или сотые доли процента), которые являются ингибиторами коррозии цинка.
Электролитом в элементах этой системы ранее был раствор хлорида аммония (классические элементы Лекланше). Хлорид аммония принимает участие в токообразующих реакциях, обеспечивает ионную проводимость электролита и стабилизирует pH электролита при незначительных токах разряда. Но образование малорастворимых комплексных соединений, выпадающих в объеме катодной массы, приводит, с одной стороны, к росту внутреннего сопротивления элемента, а с другой - к избыточному выведению электролита из области реакции. Поэтому позднее электролит из раствора хлорида аммония был заменен на раствор хлорида цинка, иногда с добавкой хлорида кальция. Такие марганцево-цинковые батарейки могут разряжаться длительное время с относительно высокими плотностями тока и имеют более пологую разрядную кривую. Хлорид цинка ускоряет загустевание электролита, обладает буферными и антигнилостными свойствами. Работоспособность таких элементов при пониженных температурах значительно выше, чем классических. Для снижения температуры замерзания электролита в его состав вводят хлорид кальция. Кроме упомянутых ранее ингибиторов коррозии цинка, иногда дополнительно вводят бихромат калия и сульфат хрома, являющийся дубителем, предотвращающим разжижение электролита при увеличении температуры.
При использовании хлорида аммония электродные процессы описываются следующим уравнением токообразующей реакции:
2MnO2 + 2NH4Cl + Zn > ZnCl2· 2NH3 + H2O + Mn2O3
При использовании хлорида цинка уравнение имеет вид:
8MnO2 + 4Zn + 2ZnCl2 + 9H2O > 8MnOOH + ZnCl2 · 4ZnO · 5H2O
Энергетические показатели элементов с хлоридно-цинковым электролитом существенно выше: при средних и повышенных токах нагрузки они могут обеспечить в 1,5-2 раза большую длительность работы. Работоспособность их при пониженных температурах тоже выше.
Конструкция солевых батареек
В солевых элементах корпус, сделанный из цинка, является отрицательным электродом 1. Положительный электрод 2 представляет из себя брикет из спрессованной активной массы, увлажненный электролитом, в центре которой расположен токоотвод 3 - угольный стержень, пропитанный составами на основе парафина для снижения потери воды из электролита. Сверху токоотвод обжат металлическим колпачком. Электролит в сепараторе 4 - загущенный. В элементах есть газовая камера 5, в которую поступают газы, выделяющиеся при разряде и саморазряде. Сверху размещают прокладку 6. Для уменьшения вероятности течи в результате питтинговой коррозии тонкостенного цинкового стакана элемент помещают в футляр 7, картонный или полимерный, иногда дополнительно применяется футляр из белой жести. В этом случае дно и верх элемента также закрывают белой жестью.
Конструкция солевой батарейки
Щелочные (Алкалиновые) батарейки
Щелочные марганцево-цинковые батарейки начали производить в середине 20 века. Одной из первых их промышленный выпуск освоила компания Duracell (США).
Окислителем является диоксид марганца, а восстановителем - цинк в виде порошка, что позволяет значительно развить поверхность и тем самым уменьшить вероятность пассивации поверхности цинка при больших токах разряда.
Для замедления коррозии раньше использовалось амальгамирование как объемное, так и поверхностное. После введения ограничений на применение ртути, применяются цинковые порошки высокой степени чистоты, легированные определенными металлами, а также органические ингибиторы коррозии.
Компоненты щелочных батареек. Активным материалом анода является порошкообразный цинк высокой степени чистоты. Для уменьшения скорости коррозии цинк может быть легирован небольшими добавками свинца, индия, висмута и алюминия. Скорость коррозии цинка существенно возрастает при увеличении содержания в нем железа, поэтому очень важно снижать долю железа до минимального уровня. Средний диаметр частиц цинка - в границах 155-255 мкм, удельная поверхность составляет около 0,02 м2/г.
Активная масса анода содержит цинк (объемная доля 18-33 %), загуститель (гель-компонент), раствор электролита, оксид цинка и ингибитор коррозии (см. таблицу). В качестве гель-компонента используют производные целлюлозы, полиакрилаты, поливиниловый спирт и другие полимеры.
Типичный состав анодной массы щелочной батарейки
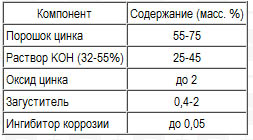
Активная масса катода содержит кроме диоксида марганца, графит либо ацетиленовую сажу, раствор KOH и связующее (см. таблицу). Содержание компонентов в активной массе катода у различных изготовителей может колебаться в широком диапазоне. Например, содержание углеродистых материалов может достигать 15 % и выше.
Типичный состав катодной массы щелочной батарейки
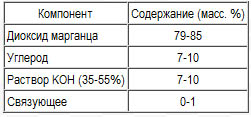
В качестве электролита применяются концентрированные растворы KOH (иногда NaOH) с добавками ZnO, а иногда и LiOH. Электролит загущен природными или синтетическими полимерными соединениями, содержащими OH-группы.
В начале процесса разряда происходит окисление цинка с образованием цинката ZnO22- (или Zn(OH)42-). После насыщения раствора электролита цинкатом, начинается вторичный процесс:
Zn + 2OH- > Zn(OH)2 + 2е-
с последующим разложением гидроксида цинка на ZnO и Н2О. На второй стадии в элементе наступает баланс выделения и поглощения ионов ОН- и щелочь не расходуется, благодаря этому для его работы хватает малого количества электролита, который заполняет только поры электродов и межэлектродное пространство.
Порошковый цинковый электрод обеспечивает существенное увеличение коэффициента использования активного материала в сравнении с солевыми элементами. При беспрерывном разряде средними и повышенными токами щелочные элементы обеспечивают емкость большую (до 7-10 раз), чем солевые элементы тех же габаритов. Щелочные элементы лучше функционируют и при низких температурах: при -20 °С отдают такую же емкость, как солевые в режиме беспрерывного разряда при комнатной температуре. Скорость саморазряда щелочных марганцево-цинковых элементов меньше: после 1 года хранения при +20 °С или 3 месяцев при +50 °С потери емкости составляют примерно 10 % начальной емкости.
Гарантийный срок хранения щелочных элементов составляет 5-7 лет, иногда он достигает 10 лет.
Итак, при одинаковых размерах солевых и щелочных батареек продолжительность работы последних при одинаковых малых токах в 1,5-2 раза больше, а при больших - в 4-10 раз больше.
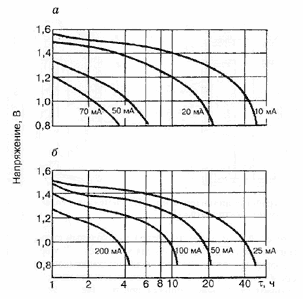
Разрядные кривые марганцево-цинкового элемента при разных токах разряда: а-солевого, б-щелочного
Конструкция щелочных батареек
Размеры цилиндрических элементов совпадают с размерами элементов марганцево-цинковой системы с солевым электролитом. В то же время, устройство щелочных батареек отличается от устройства солевых аналогов: щелочные элементы имеют как бы вывернутую конструкцию (см. рисунок). В элементах с щелочным электролитом цинк всегда находится в виде порошка, поэтому вместо цинкового стаканчика применяют стальной никелированный цилиндрический корпус, служащий токоотводом положительного электрода. Активная масса положительного электрода подпрессовывается к внутренней стенке корпуса. В щелочном элементе можно расположить больше активной массы положительного электрода, чем в солевом элементе того же объема. Например, в щелочной элемент типоразмера D можно поместить 37-41 г диоксида марганца, тогда как в солевой элемент помещается только 22-28 г. Во внутреннюю полость, образованную активной массой положительного электрода, вставляется сепаратор, пропитанный электролитом. В качестве сепарационных материалов применяются гидратцеллюлозные пленки (целлофан) либо нетканые полимерные материалы. По оси элемента размещен латунный токоотвод отрицательного электрода, а все пространство между этим токоотводом и сепаратором плотно забивается анодной пастой, состоящей из цинкового порошка, пропитанного загущенным электролитом. Часто уже при изготовлении элементов в качестве электролита применяется щелочь, предварительно насыщенная цинкатами, что позволяет избежать расходования щелочи в начале эксплуатации. Кроме того, присутствие цинкатов в электролите замедляет скорость коррозии цинка.
Устройство щелочной батарейки:
1-катод, 2-сепаратор с электролитом, 3-корпус, 4-футляр, 5-токоотвод, 6-анод, 7-дно, 8-прокладка
Из-за более плотной активной массы и применения стального корпуса щелочные батарейки при тех же размерах обычно тяжелее солевых на 25-50 %.
Емкость и энергия щелочных батареек. Как и у всех химических источников тока, емкость батареек с щелочным электролитом уменьшается при увеличении тока разряда и снижении температуры, но менее резко, чем у элементов с солевым электролитом. Удельная емкость элементов с щелочным электролитом при разряде малыми токами приблизительно в 1,5 раза превышает удельную емкость элементов с солевым электролитом. При разряде большими токами это различие достигает 4-10-кратного.
Емкость источника тока при прерывистом разряде средними и большими нормированными токами выше, чем при непрерывном разряде. Но при прерывистом разряде малыми токами емкость источника тока меньше емкости при непрерывном разряде вследствие саморазряда.
Во всем мире в производстве наблюдается стабильная тенденция по росту доли более энергоемких щелочных марганцево-цинковых элементов.
Следует еще раз особо подчеркнуть, что для уменьшения саморазряда элементов в настоящее время используются не ртуть и кадмий, а другие ингибиторы коррозии цинка которые менее токсичны.
Особенности литиевых батареек
Источники тока с более высокими энергетическими характеристиками и расширенным диапазоном эксплуатационных возможностей были разработаны при отказе от водных электролитов. Самые большие успехи были достигнуты при разработке литиевых элементов с органическим и твердым электролитом.
Первые работы по применению лития в качестве анодного материала в источниках тока появились в начале XX века, но реальное развитие они получили в 60-ых годах. Изучались источники тока с твердофазными (MnO2, CuO, I2, CFx, FeS2 и другие) и жидкофазными катодными материалами (SO2 и SOCl2). Основные характеристики литиевых элементов более всего распространенных систем показаны в таблице, ниже описаны их особенности и показаны рабочие характеристики.
Литиевые элементы различных электрохимических систем
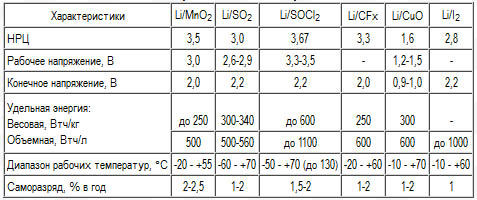
Литиевые батарейки в настоящее время в ряде областей техники успешно конкурируют с более дешевыми элементами с водным электролитом. Их применяют в часах, фотокамерах, калькуляторах, для защиты памяти интегральных схем, в измерительных приборах и медицинском оборудовании, там, где требуется высокая сохранность и постоянство рабочего напряжения в течение многих лет эксплуатации.
Существуют и мощные источники тока, способные к отдаче импульсов большой энергии даже после 10-12 лет хранения.
К герметизации литиевых батареек предъявляются повышенные требования, так как должна быть исключена вероятность не только вытекания электролита, но и попадания внутрь воздуха и паров воды, из-за чего возникает угроза пожара или взрыва элемента. Высокая реактивность лития, воздействие влажности воздуха на состояние электродов и электролита определяют и повышенные сложности при производстве элементов, необходимость проведения технологических действий в герметичных блоках с атмосферой аргона и "сухих" помещениях.
Литиевые элементы, цилиндрические и дисковые, производятся в габаритах элементов традиционных электрохимических систем. Поэтому нужно быть внимательным, чтобы не допускать ошибок случайных замен элементов с рабочим напряжением 1,5 В на литиевые, напряжение которых значительно выше. Многие компании часто стараются уменьшить эту опасность и поставляют элементы с приваренными нестандартными выводами в виде плоских лепестков, аксиальных иглообразных штырьков для впаивания элементов в схему и т.п.
Основные электрохимические системы литиевых элементов
Источники тока на базе системы литий/диоксид марганца (Li/MnO2)
Элементы Li/MnO2 с твердым катодом из диоксида марганца появились на рынке первичных литиевых источников тока одними из первых. В соответствии со стандартом МЭК в обозначении типа элемента Li/MnO2 присутствуют буквы CR..
Реакция для этой системы записывается в виде:
Li + Mn+4O2 > Mn+3O2 (Li+)
т.е. диоксид марганца восстанавливается из четырехвалентного до трехвалентного состояния с помощью лития, который внедряется в кристаллическую решетку конечного оксида. Электролит - перхлорат лития в смешанном органическом растворителе.
Напряжение разомкнутой цепи (НРЦ) элемента Li/MnO2 - 3,5В, номинальное напряжение - 3В, хотя первоначальное напряжение при подключении нагрузки может быть и немного выше. Конечное напряжение - 2В. Рабочий диапазон температур как правило от -20 до +55 °С. Срок хранения - до 10 лет при саморазряде порядка 1% в год (и не более 2-2,5%).
Источники тока на основе системы литий/оксид меди (Li/CuO)
Элементы Li/CuO имеют рабочее напряжение, сопоставимое с напряжением щелочных марганцево-цинковых элементов. Но в них удалось достигнуть в 3 раза большей удельной энергии.
При разряде имеет место реакция:
2Li + CuO > Li2O + Cu
при этом разрядный процесс протекает в несколько этапов:
CuO > Cu2O > Cu
Напряжение разомкнутой цепи (НРЦ) элементов - 2,5В, рабочее напряжение 1,2-1,5В в зависимости от тока разряда. Начального провала напряжения не наблюдается.
Элемент Li/CuO работоспособен в интервале температур от -10 до +70 °С. Срок хранения элементов при 20 °С - до 10 лет. Элементы широкого распространения не получили.
Источники тока на базе системы литий/иод (Li/I2)
Элементы системы Li/I2 отличаются от прочих литиевых элементов тем, что они не содержат жидкого электролита и не требуют применения специального сепаратора.
Работа источника тока Li/I2 основана на реакции:
2Li + I2 > 2LiI
При прямом контакте йодсодержащего катода и лития в результате прямой химической реакции образуется твердый иодид лития LiI, который является электролитом и в то же время играет роль сепаратора, разделяющего два активных материала.
НРЦ элемента - 2,8В. Напряжение его определяется сопротивлением слоя иодида лития, который по мере разряда постепенно накапливается в межэлектродном пространстве и вызывает линейное снижение напряжения до 2,2-2,4В. Когда весь запас йода закончится, напряжение резко падает.
Элементы обеспечивают сохранность в течение 10-15 лет при саморазряде около 10% за весь срок службы. Саморазряд определяется реакцией лития и йода, который диффундирует через слой йодида лития. Потери на саморазряд зависят от толщины слоя LiI и поэтому в наибольшей степени имеют место на начальной фазе работы: все потери на саморазряд проявляются при разряде не более чем на 25-30%.
При работе элементов Li/I2 не образуется газов. Общий объем их постоянен в течение всего периода работы. Они переносят значительные нарушения условий эксплуатации без каких-либо последствий.
Специфичный механизм работы элемента и его характеристики делают его пригодным для выполнения задач, требующих повышенной надежности. Источники тока с емкостью порядка нескольких ампер-часов применяются в устройствах для медицинских применений, прежде всего имплантируемых кардиостимуляторов. Они работоспособны в интервале температур от -10 до +60 °С.
Источники тока на основе системы литий/полифторуглерод
Удельная энергия элемента достигает 250 Втч/кг и 600 Втч/л. Эти элементы дороже, чем элементы Li/MnO2, однако они сохраняют работоспособность при более высокой температуре и поэтому находят применение в первую очередь в устройствах, нагревающихся в течении работы.
Токообразующая реакция имеет вид:
nLi + (CFx)n > nLiFx + nC
В процессе разряда превращения, совершающиеся во фторированном углероде, приводят к росту электропроводности положительного электрода, и условия разряда улучшаются.
НРЦ элемента составляет 3,2-3,3В, рабочее напряжение постоянно на протяжении почти всего разряда в широком интервале температур (от -40 до +85 °С). Конечное напряжение -2В.
Элементы теряют не более 20% Сн, при хранении более 10 лет.
Литий-фторуглеродные элементы были коммерциализированы более 30 лет назад и в настоящее время применяются главным образом в качестве источников питания портативной электронной аппаратуры, особенно такой, которая разогревается в ходе работы. Но при температуре ниже 0 °С и средних и больших токах разряда эти элементы уступают более дешевым элементам системы Li/MnO2.
Элементы Li/CFx обеспечивают гораздо более высокую мощность, чем элементы системы Li/I2, и поэтому успешно используются для их замены в кардиостимуляторах нового поколения, а также в имплантируемых дефибрилляторах.
Источники тока на базе системы литий/дисульфид железа (Li/FeS2)
В последнее время, несмотря на высокую стоимость, востребованными оказались элементы системы Li/FeS2, что определено рядом неоспоримых достоинств.
Реакция, протекающая при их разряде, имеет вид
4Li + FeS2 > 2Li2S + Fe
Удельная энергия этих элементов достигает 300 Втч/кг и 600 Втч/л, сохранность - 15 лет и более. Они работоспособны при температуре -40 °С, что могут обеспечить только литиевые элементы с жидкофазными катодами. Li/FeS2 элементы имеют лучшие характеристики, в особенности при большой потребляемой мощности.
В конструкцию этих источников питания обязательно вводятся элементы защиты для ограничения тока непрерывного потребления (2А для элементов типоразмера АА) и устройство с положительным температурным коэффициентом сопротивления, отсоединяющим нагрузку при достижении температуры 85-95 °С. Кроме того, элементы имеют аварийный клапан для сброса давления газа, которое может появиться при их разогреве до 130-160 °С.
Источники тока на основе системы литий/диоксид серы (Li/SO2)
Литиевые элементы системы литий/диоксид серы с жидкофазным катодным материалом хорошо исследованы и широко распространены. В качестве катода в элементах применяется смесь сажи с графитом и связующим, которая наносится на металлическую основу. Электролит элемента состоит из диоксида серы SO2 (70-75% по объему) с добавками для обеспечения необходимой электропроводности.
Электрохимическая реакция, которая протекает в элементе при подключении нагрузки, имеет вид:
2Li + 2SO2 > Li2S2O4
НРЦ элементов Li/SO2 - 3В. Элементы этой системы обладают большой удельной мощностью и работоспособны в диапазоне температур от -60 до +70 °С. Разрядное напряжение 2,6-2,9В, в зависимости от плотности тока.
К недостаткам Li/SO2 элементов относятся большое внутреннее давление и опасность сильного нагрева при коротких замыканиях. Для предотвращения нежелательных эффектов в корпусе устанавливают специальный предохранитель, который срабатывает при 100 °С и обеспечивает сбрасывание излишнего давления газа.
Из-за повышенного давления элементы производятся чаще всего в цилиндрической конструкции, бобинной и рулонной. В первом случае литиевый анод запрессовывается по периферии, а прессованный угольный катод располагается в центре. При рулонной сборке пакета электродов обеспечиваются более высокие энергетические характеристики. Срок хранения батареек Li/SO2 - до 10 лет. Саморазряд происходит за счет реакции лития с электролитом, скорость его не превышает 1-2 % в год при 20 °С.
Источники тока на базе системы литий/тионилхлорид (Li/SOCl2)
Элементы системы Li/SOCl2 с жидкофазным катодом располагают наилучшими удельными характеристиками среди литиевых первичных источников тока.
Реакция, протекаемая при разряде, имеет вид:
4Li + 2SOCl2 > 4LiCl + SO2 + S
Так как большая часть SO2 растворяется в электролите, давления в элементе не появляется.
НРЦ элементов - 3,67 В, рабочее напряжение 3,3-3,5 В в зависимости от тока разряда. Они работоспособны в интервале температур от -60 до +85 °С, некоторые до +130 °С. Конструкция элементов Li/SOCl2 подобна конструкции элементов Li/SO2, но тионилхлорид значительно агрессивнее других электролитов, вследствие этого обеспечение их пожаро- и взрывобезопасности потребовало больших усилий и от разработчиков, и от технологов.
Срок хранения этих элементов до 10 лет при саморазряде 1,5-2% в год при 20 °С.
При низкой температуре (порядка -50 °С) элементы отдают емкость в несколько раз меньше номинальной. Если после этого они переносятся в теплое помещение, разряд продолжается и может иметь место существенный их разогрев за счет разложения промежуточных продуктов реакции вплоть до взрыва.
Для увеличения безопасности эксплуатации, литиевые элементы могут быть снабжены аварийными клапанами для сброса газа, плавкими предохранителями, тепловыми выключателями.
Химические источники электропитания, которые производятся и хранятся в неактивированном состоянии и перед началом разряда активируются (приводятся в рабочее состояние) тем или иным способом, относятся к резервным источникам питания. К основным особенностям этих резервных батарей относятся:
- возможность длительного хранения батареи в неактивированном состоянии;
- относительно короткий срок разряда, который, как правило, проводится однократно и непрерывно;
- использование энергоемких и (или) высокоактивных реагентов;
- высокие значения удельной мощности.
В зависимости от способа активации все резервные химические источники питания подразделяются на четыре типа:
- водоактивируемые источники тока;
- химические источники тока, активируемые раствором электролита;
- газоактивируемые источники питания;
- тепловые батареи (резервные источники питания, активируемые теплотой).
Водоактивируемые резервные источники питания активируются заливкой водой или погружением в воду. Резервные батареи могут активироваться водным раствором электролита: кислоты, щелочи или соли или неводным раствором электролита. Резервные батареи, активируемые водными растворами кислот и щелочей или неводными электролитами получили название ампульных химических источников тока. К резервным также можно отнести некоторые воздушно-магниевые и воздушно-алюминиевые одноразовые батареи.
В качестве газообразного активатора резервных батарей применяется аммиак. Тепловые батареи содержат эвтектическую смесь хлоридов щелочных металлов в качестве электролита, который при невысоких температурах обладает очень низкой электрической проводимостью, поэтому разряда источника питания не происходит. При плавлении электролита источник тока активируется.
Кратко охарактеризуем различные виды резервных источников питания.
Водоактивируемые резервные источники питания. В качестве анодных материалов обычно используются магниевые сплавы, реже цинк. Катодными реагентами служат малорастворимые хлориды серебра, меди или свинца или диоксид свинца. Электролитом является хлорид натрия, который при активации растворяется в воде и обеспечивает ионную проводимость. Активация может также проводиться заливкой резервной батареи морской водой или погружением батареи в морскую воду. Первые водоактивируемые источники тока (системы Mg-AgCl) появились в 1943 г. (США), в 1949 г. началось производство батарей резервного питания системы Mg-CuCl.
К достоинствам водоактивируемых батарей резервного питания относятся простота устройства и активации, способность работать при низких температурах после активации, высокие (для системы Mg-AgCl) и средние (для других систем) удельные энергии и мощности. К недостаткам батарей резервного питания можно отнести высокий саморазряд после активации, токи утечки в резервных батареях и высокую стоимость источников тока системы Mg-AgCl.
Водоактивируемые батарей резервного питания применяются в морских сигнальных устройствах, спасательных средствах, на буях, геофизической аппаратуре, метеорологических шарах-зондах; резервные батареи системы Mg-AgCl в торпедах и акустических буях.
Батареи резервного питания активируемые раствором электролита (ампульные источники тока). Ампульные батареи получили распространение в начале 50-х годов XX в. В ампульных источниках питания раствор электролита хранится в отдельной емкости (ампуле) и заливается при активации. Применяемые в настоящее время ампульные батареи резервного питания можно разделить на источники тока с водными и неводными электролитами. В первых анодами служат цинк, свинец или магний, катодными материалами - оксид серебра, диоксид свинца или марганца, электролитами - растворы кислот, щелочи или соли. Во втором типе источники тока анодом является литий, катодными материалами - тионилхлорид, диоксид серы, пентаоксид ванадия или сульфид железа, электролитами - неводные растворы солей лития. Активация батареи резервного питания происходит за очень короткое время (от долей секунды до нескольких секунд). К достоинствам ампульных источников тока относятся длительная сохраняемость в неактивированном состоянии (10 и более лет), высокая удельная мощность, а для некоторых - и удельная энергия, широкий диапазон рабочих температур (для большинства батарей резервного питания). К недостаткам можно отнести короткое время работы и малый допустимый срок хранения в активированном состоянии. Ампульные резервные батареи применяются в авиакосмической и военной технике.
Батареи резервного питания активируемые аммиаком. Анодом служит либо магний, либо цинк, катодным компонентом - m-динитробензол (m-ДНБ) или диоксид свинца, электролитом - роданиды аммиака. Активация производится либо жидким, либо газообразным аммиаком. К достоинствам резервных батарей этого типа относятся длительная сохранность в неактивированном состоянии и широкий диапазон рабочих температур. Недостатками являются относительно медленная активация и небольшое время разряда.
Тепловые батареи резервного питания. Промышленный выпуск тепловых резервных батарей начался в конце 40-х годов XX в. Анодами первоначально служили кальций и магний. В последние годы для этой цели в основном применяются сплавы лития. Катодами в кальциевых резервных источниках тока ранее служил хромат кальция, в литиевых батареях используется дисульфид железа и пентаоксид ванадия. В качестве электролита используется смесь хлоридов лития и калия. При нагревании до 450 °С и выше, осуществляемом обычно с помощью пиротехнических составов, электролит расплавляется и элементы активируются. Время активации составляет 0,1-3 с. Резервные источники конструктивно выполняется в виде батареи, состоящей из большого числа последовательно соединенных элементов и чередующихся нагревателей. К достоинствам тепловых батарей резервного питания относятся высокая удельная мощность, способность работать в широком диапазоне температур окружающей среды и длительная сохранность в неактивированном состоянии. Недостатками батарей являются короткий срок разряда из-за остывания электролита и невысокая степень использования активных масс. Тепловые резервные батареи применяются в военной технике: в артиллерийских снарядах, ракетах и т.д.
Мобильная электроника с каждым годом, если не месяцем, становится все доступнее и распространеннее. Тут вам и ноутбуки, и КПК, и цифровые фотоаппараты, и мобильники, и еще масса всяких полезных и не очень устройств. И все эти устройства непрерывно обзаводятся новыми функциями, более мощными процессорами, большими цветными экранами, беспроводной связью, в то же время уменьшаясь в размерах. Но, в отличие от полупроводниковых технологий, технологии питания всего этого мобильного зверинца идут совсем не семимильными шагами. Обычных аккумуляторов и батарей становится явно недостаточно для питания последних достижений электронной индустрии в течение сколько-нибудь существенного времени. А без надежных и емких батарей теряется весь смысл мобильности и беспроводности. Так что компьютерная индустрия все активнее и активнее трудится над проблемой альтернативных источников питания. И наиболее перспективным, на сегодняшний день, направлением здесь являются топливные элементы.
Топливные элементы были открыты еще в далеком 1839 гуду сэром Вильямом Гровом, когда он изучал электролиз воды. Отключив от электролитической ячейки батарею, Грове с удивлением обнаружил, что электроды начали поглощать выделившийся газ и вырабатывать ток. Открытие процесса электрохимического "холодного" горения водорода стало знаменательным событие в энергетике, и в дальнейшем такие известные электрохимики, как Оствальд и Нернст, сыграли большую роль в развитии теоретических основ и практической реализации топливных элементов и предсказали им большое будущее.
Сам термин "топливный элемент" (Fuel Cell) появился позднее - он был предложен в 1889 году Людвигом Мондом и Чарльзом Лангером, пытавшимися создать устройство для выработки электричества из воздуха и угольного газа.
При обычном горении в кислороде протекает окисление органического топлива, и химическая энергия топлива неэффективно переходит в тепловую энергию. Но оказалось возможным реакцию окисления, например водорода с кислородом, провести в среде электролита и при наличии электродов получить электрический ток. Например, подавая водород к электроду, находящемуся в щелочной среде, получим электроны:
2H2 + 4OH- > 4H2O + 4e-
которые, проходя по внешней цепи, поступают на противоположный электрод, к которому поступает кислород и где проходит реакция:
4e- + O2 + 2H2O > 4OH-
Видно, что результирующая реакция 2H2 + O2 > H2O - такая же, что и при обычном горении, но в топливном элементе, или иначе - в электрохимическом генераторе, получается электрический ток с большой эффективностью и частично тепло. Отметим, что в топливных элементах в качестве горючего могут также применяться уголь, окись углерода, спирты, гидразин, другие органические вещества, а в качестве окислителей - воздух, перекись водорода, хлор, бром, азотная кислота и т.д.
Развитие топливных элементов энергично продолжалось как за рубежом, так и в России, а далее и в СССР. Среди ученых, сделавших большой вклад в изучение топливных элементов, отметим В. Жако, П. Яблочкова, Ф. Бэкона, Э. Бауэра, Э. Юсти, К. Кордеша. В середине прошлого столетия начался новый штурм проблем топливных элемент. Частично это объясняется появлением новых идей, материалов и технологий в результате оборонных исследований. Одним из ученых, сделавших крупный шаг в развитие топливных элементов, был П. М. Спиридонов. Водород-кислородные элементы Спиридонова давали плотность тока 30 мА/см2, что для того времени считалось большим достижением. В сороковые годы О. Давтян создал установку для электрохимического сжигания генераторного газа, получаемого газификацией углей. С каждого кубометра объема элемента Давтян получил 5 кВт мощности. Это был первый топливный элемент на твердом электролите. Он имел высокий КПД, но со временем электролит приходил в негодность, и его нужно было менять. Впоследствии Давтян в конце пятидесятых годов создал мощную установку, приводящую в движение трактор. В те же годы английский инженер Т. Бэкон сконструировал и построил батарею топливных элементов общей мощностью 6 кВт и КПД 80 %, работающую на чистом водороде и кислороде, но отношение мощности к весу батареи оказалось слишком малым - такие элементы были непригодны для практического применения и слишком дорогими.
В последующие годы время одиночек прошло. Топливными элементами заинтересовались создатели космических аппаратов. С середины 60-ых миллионы долларов вкладывались в исследования топливных элементов. Работа тысяч ученых и инженеров позволила выйти на новый уровень, и в 1965г. топливные элементы был испытан в США на космическом корабле "Джемини-5", а в дальнейшем - на кораблях "Аполлон" для полетов на Луну и по программе "Шатл". В СССР топливные элементы разрабатывали в НПО "Квант", тоже для использования в космосе. В те годы уже появились новые материалы - твердополимерные электролиты на основе ионообменных мембран, новые типы катализаторов, электродов. И все-таки рабочая плотность тока была небольшой - в пределах 100-200 мА/см2, а содержание платины на электродах - несколько г/см2. Существовало много проблем, связанных с долговечностью, стабильностью, безопасностью.
Следующий этап бурного развития топливных элементов начался в 90-е гг. прошлого столетия и продолжается и сейчас. Он вызван потребностью в новых эффективных источниках энергии в связи, с одной стороны, с глобальной экологической проблемой усиливающегося выброса парниковых газов при сгорании органического топлива и, с другой стороны, с исчерпанием запасов такого топлива. Так как в топливном элементе конечным продуктом сгорания водорода является вода, то они считаются наиболее чистыми с точки зрения влияния на окружающую среду. Основная проблема заключается только в нахождении эффективного и недорогого способа получения водорода. Миллиардные финансовые вложения на развитие топливных элементов и генераторов водорода должны привести к технологическому прорыву и сделают реальностью их использование в повседневной жизни: в элементах для сотовых телефонов, в автомобилях, на электростанциях. Уже в настоящее время такие автомобильные гиганты, как "Баллард", "Хонда", "Даймлер Крайслер", "Дженерал Моторс" демонстрируют легковые автомобили и автобусы, работающие на топливных элементах мощностью 50кВт. Рядом компаний разработаны демонстрационные электростанции на топливных элементах с твердооксидным электролитом мощностью до 500 кВт. Но, несмотря на значительный прорыв в улучшении характеристик топливных элементов, нужно решить еще много проблем, связанных с их стоимостью, надежностью, безопасностью.
В топливном элементе в отличии от батареек и аккумуляторов - и горючее, и окислитель подаются в него извне. Топливный элемент является только посредником в реакции и в идеальных условиях мог бы работать практически вечно. Красота этой технологии в том, что фактически в элементе происходит сжигание топлива и непосредственное превращение выделяющейся энергии в электричество. При прямом сжигании топлива оно окисляется кислородом, а выделяющееся при этом тепло идет на совершение полезной работы. В топливном элементе, как и в батарейках, реакции окисления топлива и восстановления кислорода пространственно разделены, и процесс "сжигания" протекает, только если элемент отдает ток в нагрузку. Это все равно что дизельный электрогенератор, только без дизеля и генератора. А также без дыма, шума, перегрева и с намного более высоким КПД. Последнее объясняется тем, что, во-первых, нет промежуточных механических устройств и, во-вторых, топливный элемент не является тепловой машиной и вследствие этого не подчиняется закону Карно (то есть, его эффективность не определяется разницей температур).
В качестве окислителя в топливных элементах применяется кислород. Причем, поскольку кислорода вполне достаточно в воздухе, то волноваться о подаче окислителя не надо. Что касается топлива, то им является водород. Итак, в топливном элементе протекает реакция:
2H2 + O2 > 2H2O + электричество + тепло.
В итоге получается полезная энергия и водяной пар. Самым простым по своему устройству является топливный элемент с протонообменной мембраной (см. рисунок 1). Работает он следующим образом: попадающий в элемент водород разлагается под действием катализатора на электроны и положительно заряженные ионы водорода H+. Затем в действие вступает специальная мембрана, исполняющая здесь роль электролита в обычной батарейке. В силу своего химического состава она пропускает через себя протоны, но задерживает электроны. Таким образом, скопившиеся на аноде электроны создают избыточный отрицательный заряд, а ионы водорода создают положительный заряд на катоде (напряжение на элементе получается порядка 1В). Для создания большой мощности, топливный элемент собирают из множества ячеек. Если включить элемент в нагрузку, то электроны потекут через нее к катоду, создавая ток и завершая процесс окисления водорода кислородом. В качестве катализатора в таких топливных элементах как правило применяются микрочастицы платины, нанесенные на углеродное волокно. Благодаря своей структуре такой катализатор хорошо пропускает газ и электричество. Мембрана как правило производится из серосодержащего полимера нафиона. Толщина мембраны равна десятым долям миллиметра. При реакции, конечно, выделяется и тепло, но его не так уж много, так что рабочая температура поддерживается в области 40-80°С.
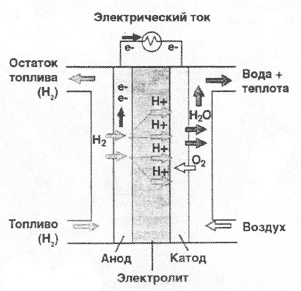
Рис.1. Принцип действия топливного элемента
Имеются и другие типы топливных элементов, в основном, отличающиеся типом применяемого электролита. Практически все они требуют в качестве топлива водород, так что возникает логичный вопрос: где его взять. Конечно, можно было бы употреблять сжатый водород из баллонов, но тут сразу же появляются проблемы связанные с транспортировкой и хранением этого весьма огнеопасного газа под большим давлением. Разумеется, можно использовать водород в связанном виде как в металлгидридных аккумуляторах. Но все же остается задача его добычи и транспортировки, ведь инфраструктуры водородных заправок не существует.
Впрочем, тут тоже есть решение - в качестве источника водорода можно применять жидкое углеводородное топливо. Например, этиловый или метиловый спирт. Правда, тут уже требуется специальное дополнительное устройство - топливный преобразователь, при высокой температуре (для метанола это будет где-то 240°С) преобразующее спирты в смесь газообразных H2 и CO2. Но в этом случае уже сложнее думать о портативности - такие устройства хорошо применять в качестве стационарных или автомобильных генераторов, а вот для компактной мобильной техники нужно что-нибудь менее громоздкое.
И тут мы приходим именно к тому устройству, разработкой которого со страшной силой занимаются практически все крупнейшие производители электроники - метаноловому топливному элементу (рисунок 2).
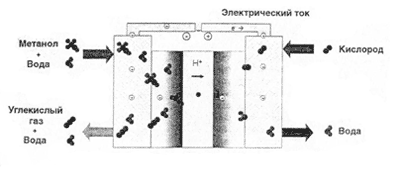
Рис.2. Принцип действия топливного элемента на метаноле
Принципиальная разница между водородным и метанольным толивными элементами заключается в применяемом катализаторе. Катализатор в метанольном топливном элементе позволяет отрывать протоны непосредственно от молекулы спирта. Таким образом, решается вопрос с топливом - метиловый спирт массово производится для химической промышленности, его легко хранить и транспортировать, а для зарядки метанолового топливного элемента достаточно просто заменить картридж с топливом. Правда, есть один значительный минус - метанол токсичен. К тому же эффективность метанольного топливного элемента значительно ниже, чем у водородного. Самый заманчивый вариант - использовать в качестве топлива этиловый спирт, благо производство и распространение алкогольных напитков любого состава и крепости хорошо налажено по всему земному шару. Однако эффективность этаноловых топливных элементов, к сожалению, еще ниже, чем у метаноловых.
Как уже отмечалось за много лет разработок в области топливных элементов, построены различные типы топливных элементов. Топливные элементы классифицируются по электролиту и виду топлива.
1. Твердополимерные водород-кислородные электролитные.
2. Твердополимерные метанольные топливные элементы.
3. Элементы на щелочном электролите.
4. Фосфорно-кислотные топливные элементы.
5. Топливные элементы на расплавленных карбонатах.
6. Твердооксидные топливные элементы.
В идеале КПД топливных элементов очень высок, но в реальных условиях имеются потери, связанные с неравновесными процессами, такими как: омические потери вследствие удельной проводимости электролита и электродов, активационная и концентрационная поляризация, диффузионные потери. Вследствие этого часть энергии, вырабатываемой в топливных элементах, превращается в тепловую. Усилия специалистов направлены на уменьшение указанных потерь. Главным источником омических потерь, а также причиной высокой цены топливных элементов являются перфторированные сульфокатионитные ионообменные мембраны. Сейчас идут поиски альтернативных, более дешевых протонпроводящих полимеров. Поскольку проводимость этих мембран (твердых электролитов) достигает приемлемого значения (10 Ом/см) только при наличии воды, то газы, подаваемые в топливный элемент, надо дополнительно увлажнять в специальном устройстве, что тоже вызывает удорожание системы. В каталитических газодиффузионных электродах применяется, в основном, платина и некоторые другие благородные металлы, и до сих пор им замены не найдено. Хотя содержание платины в топливных элементах составляет несколько мг/см2, для больших батарей ее количество достигает десятков граммов.
При конструировании топливных элементов большое внимание уделяют системе теплоотвода, так как при высоких плотностях тока (до 1А/см2) происходит саморазогрев системы. Для охлаждения применяют циркулирующую в топливном элементе по специальным каналам воду, а при небольших мощностях - обдув воздухом. Итак, современная система электрохимического генератора кроме самой батареи топливных элементов "обрастает" множеством вспомогательных устройств, таких как: насосы, компрессор для подачи воздуха, напуска водорода, увлажнитель газов, охлаждающий узел, система контроля утечки газов, конвертер постоянного тока в переменный, управляющий процессор и др. Все это ведет к тому, что стоимость системы топливных элементов в 2004-2005 годах составляла 2-3 тыс. $/кВт. Согласно оценке экспертов, топливные элементы станут доступными для применения на транспорте и в стационарных энергоустановках при цене 50-100 $/кВт.
Для введения топливных элементов в повседневную жизнь, наряду с удешевлением компонентов, нужно ожидать новых оригинальных идей и подходов. В частности, большие надежды связывают с применением наноматериалов и нанотехнологий. Например, недавно несколько компаний заявили о создании сверх-эффективных катализаторов, в частности, для кислородного электрода на основе кластеров наночастиц из различных металлов. Кроме того, появились сообщения о конструкции топливных элементов без мембран, в которых жидкое топливо (например, метанол) подается в топливный элемент вместе с окислителем. Интересной является также развиваемая концепция биотопливных элементов, работающих в загрязненных водах и потребляющих в качестве окислителя растворенный кислород воздуха, а органические примеси в качестве топлива.
По прогнозам специалистов, топливные элементы выйдут на массовый рынок в ближайшие годы. И действительно, разработчики друг за другом побеждают технические проблемы, рапортуют об успехах и представляют прототипы топливных элементов. Например, компания Toshiba продемонстрировала готовый прототип метанолового топливного элемента. Он имеет размер 22x56x4,5мм и дает мощность порядка 100мВт. Одной заправки в 2 кубика концентрированного (99,5%) метанола достаточно на 20 часов работы МРЗ-плеера. Toshiba выпустила коммерческий топливный элемент для питания мобильников. Опять же, та же Toshiba демонстрировала элемент для питания ноутбуков размером 275x75x40мм, дающий возможность компьютеру работать в течение 5 часов от одной заправки.
Не отстает от Toshiba и другая японская компания - Fujitsu. В 2004-м году она тоже представила элемент, действующий на 30% водном растворе метанола. Этот топливный элемент работал на одной заправке в 300мл на протяжении 10 часов и при этом выдавал мощность 15 Вт. Casio разрабатывает топливный элемент, в котором метанол сперва перерабатывается в смесь газообразных H2 и CO2 в миниатюрном топливном преобразователе, а потом уже подается в топливный элемент. Во время демонстрации прототип Casio обеспечивал энергией ноутбук в течение 20 часов. Компания Samsung тоже отметилась на ниве топливных элементов - в 2004-м году она демонстрировала свой прототип мощностью 12 Вт, предназначенный для питания ноутбука. Вообще же, Samsung предполагает применять топливные элементы, в первую очередь, в смартфонах четвертого поколения.
Надо сказать, что японские компании вообще очень обстоятельно подошли к разработке топливных элементов. Еще в 2003-м году такие компании как Canon, Casio, Fujitsu, Hitachi, Sanyo, Sharp, Sony и Toshiba объединили усилия с тем, чтобы разработать единый стандарт топливных элементов для ноутбуков, мобильных телефонов, КПК и других электронных устройств. Американские же компании, которых тоже немало на этом рынке, в большинстве своем работают по контрактам с военными и разрабатывают топливные элементы для электрификации американских солдат. Не отстают и немцы - компания Smart Fuel Cell продает топливные элементы для питания мобильного офиса. Устройство называется Smart Fuel Cell C25, имеет габариты 150x112x65мм и может выдавать до 140 ватт-часов на одной заправке. Этого достаточно для питания ноутбука примерно в течение 7 часов. Затем картридж можно заменить и можно работать дальше. Размер картриджа с метанолом 99x63x27 мм, а весит он 150г. Сама система весит 1,1 кг, так что совсем уж портативной ее не назовешь, но все же это вполне законченное и удобное устройство. Также компания разрабатывает топливный модуль для питания профессиональных видеокамер.
В общем, топливные элементы уже практически вышли на рынок мобильной электроники. Производителям осталось решить последние технические задачи перед тем, как начать массовый выпуск.
Во-первых, необходимо решить вопрос с миниатюризацией топливных элементов. Ведь чем меньше топливный элемент, тем меньшую мощность он сможет выдавать - так что постоянно разрабатываются новые катализаторы и электроды, позволяющие при малых размерах максимально увеличить рабочую поверхность. Тут как раз очень кстати приходятся последние разработки в области нанотехнологий и наноматериалов (например, нанотрубки). Опять же, для миниатюризации обвязки элементов (топливных и водяных насосов, систем охлаждения и преобразования топлива) все шире начинают применяться достижения микроэлектромеханики.
Вторая важная проблема, требующая решения - это цена. Ведь в качестве катализатора в большинстве топливных элементов применяется очень дорогая платина. Опять же, некоторые из производителей пытаются по максимуму использовать уже хорошо отработанные кремниевые технологии.
Что касается других областей использования топливных элементов, то топливные элементы там уже достаточно прочно обосновались, хотя пока и не стали мэйнстримом ни в энергетике, ни на транспорте. Уже очень многие производители автомобилей представили свои концепт-кары с питанием от топливных элементов. В нескольких городах мира колесят автобусы на топливных элементах. Канадская Ballard Power Systems выпускает целый ряд стационарных генераторов мощностью от 1 до 250 кВт. При этом, киловаттные генераторы рассчитаны на то, чтобы сразу снабжать одну квартиру электричеством, теплом и горячей водой.
Еще в древности люди начали задумываться о возможностях применения солнечной энергии. Согласно легенде, великий греческий ученый Архимед сжег неприятельский флот, осадивший его родной город Сиракузы, с помощью системы зажигательных зеркал. Доподлинно известно, что около 3000 лет назад султанский дворец в Турции отапливался водой, нагретой солнечной энергией. Древние жители Африки, Азии и Средиземноморья получали поваренную соль, выпаривая морскую воду. Однако больше всего людей привлекали опыты с зеркалами и увеличительными стеклами. Настоящий "солнечный бум" начался в XVIII столетии, когда наука, освобожденная от пут религиозных суеверий, пошла вперед семимильными шагами. Первые солнечные нагреватели появились во Франции. Естествоиспытатель Ж. Бюффон создал большое вогнутое зеркало, которое фокусировало в одной точке отраженные солнечные лучи. Это зеркало было способно в ясный день быстро воспламенить сухое дерево на расстоянии 68 метров. Вскоре после этого шведский ученый Н. Соссюр построил первый водонагреватель. Это был всего лишь деревянный ящик со стеклянной крышкой, однако вода, налитая в немудреное приспособление, нагревалась солнцем до 88°С. В 1774 году великий французский ученый А. Лавуазье впервые применил линзы для концентрации тепловой энергии солнца. Вскоре в Англии отшлифовали большое двояковыпуклое стекло, расплавлявшее чугун за три секунды и гранит - за минуту.
Первые солнечные батареи, способные преобразовывать солнечную энергию в механическую, были построены опять-таки во Франции. В конце XIX века на Всемирной выставке в Париже изобретатель О. Мушо демонстрировал инсолятор - аппарат, который при помощи зеркала фокусировал лучи на паровом котле. Котел приводил в действие печатную машину, печатавшую по 500 оттисков газеты в час. Через несколько лет в США построили подобный аппарат мощностью в 15 лошадиных сил.

Рис.1. Паровой котел на солнечной энергии, приводящий в движение печатный станок
Подходили годы, инсоляторы использующие солнечную энергию совершенствовались, но принцип оставался прежним: солнце - вода - пар. Но вот, в 1953 году ученые Национального аэрокосмического агентства США создали настоящую солнечную батарею - устройство, непосредственно преобразующее энергию солнца в электричество.
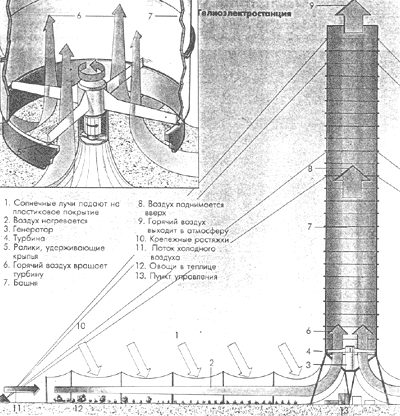
Рис.2.
Еще в 70-х годах 19 века был открыт так называемый фотоэлектрический эффект - явление, связанное с освобождением электронов твердого тела или жидкости под действием электромагнитного излучения. В 30-х годах глава физиков нашей страны академик А. Ф. Иоффе высказал мысль о использовании полупроводниковых фотоэлементов в солнечной энергетике. Правда, рекордный коэффициент полезного действия (КПД) тогдашних материалов не превышал 1 процента, то есть, в электричество превращалась лишь сотая часть световой энергии. После многолетних экспериментов удалось создать фотоэлементы с КПД до 10-15%. Затем американцы построили солнечные батареи современного типа. В 1959 году они были установлены на одном из первых искусственных спутников Земли, и с тех пор все космические станции оснащаются многометровыми панелями с солнечными батареями. Низкий КПД солнечных батарей можно было бы компенсировать большой площадью, например покрыть всю пустыню Сахару фотоэлементами - и готова мощнейшая солнечная электростанция. Однако кремниевые полупроводники, на основе которых производятся солнечные батареи, очень дорого стоят. И чем выше КПД, тем дороже материалы. Вследствие этого доля солнечной энергии в сегодняшней энергетике невелика. Однако в связи с не бесконечностью ископаемого топлива, доля энергии получаемой солнечными батареями будет неминуемо возрастать. Так же росту использования солнечных батарей способствуют разработки направленные на повышение КПД и понижение их стоимости.
Одно из главных достоинств солнечной энергии - ее экологическая чистота. Правда, соединения кремния могут наносить небольшой вред окружающей среде, однако по сравнению с последствиями сжигания природного топлива такой ущерб - капля в море.
Полупроводниковые солнечные батареи имеют очень важное достоинство - долговечность. При том, что уход за ними не требует от персонала особенно больших знаний. Вследствие этого солнечные батареи становятся все более популярными в промышленности и быту.
Несколько квадратных метров солнечных батарей вполне могут решить все энергетические проблемы небольшой деревушки. В странах с большим количеством солнечных дней - южной части США, Испании, Индии, Саудовской Аравии и прочих - давно уже действуют солнечные электростанции. Некоторые из них достигают довольно внушительной мощности.
Сегодня уже разрабатываются проекты строительства солнечных электростанций за пределами атмосферы - там, где солнечные лучи не теряют своей энергии. Уловленное на земной орбите излучение предлагается переводить в другой тип энергии - микроволны - и затем уже отправлять на Землю. Все это заучит фантастично, однако современная технология позволяет осуществить такой проект в самом близком будущем.

Рис.3. Солнечные батареи на верблюде
Большинство солнечных отопительных систем представляет собой солнечные коллекторы разных конструкций, где для приема и передачи тепла применяются жидкости - вода или масло. Как правило, эти системы состоят из трубчатого радиатора, наполненного жидкостью. Радиатор изготовлен из материалов темного цвета или находится под темной пластинкой. Вся система покрыта сверху стеклом. Солнечное излучение, проникая сквозь стекло, нагревает жидкость, поступающую далее в специальную теплоизолирующую емкость. С другой стороны в радиатор закачивается холодная вода, чтобы, нагревшись, повторить тот же путь. Разумеется, такая система не даст высоких температур, однако уловить даже долю даровой энергии, тоже какая то экономия.
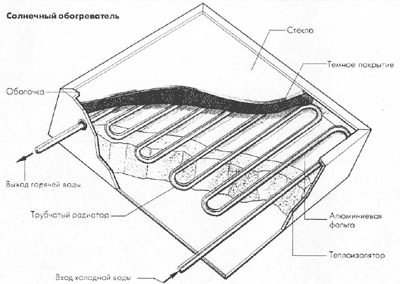
Рис.4. Солнечный водонагреватель
Гораздо эффективнее действует вакуумный коллектор - он может подогреть жидкость до 300°С. Такая температура достигается за счет того, что вся система работает в вакууме, то есть, в безвоздушном пространстве. Нет воздуха - значит некому красть тепло из обогревателя.
Имеется множество типов обогревателей, работающих по принципу фокусировки солнечных лучей в небольшом пространстве. В них достигаются самые высокие температуры. Системы зеркал или увеличительных стекол концентрируют солнечное излучение на уже знакомом нам трубчатом радиаторе, заполненном жидкостью. Последняя очень быстро нагревается и поступает в общую отопительную систему здания.
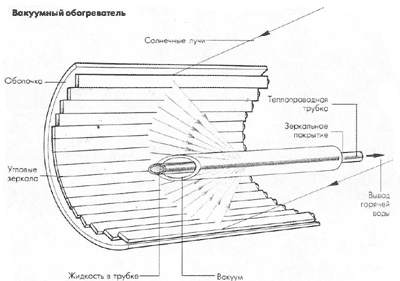
Рис.5. Вакуумный солнечный водонагреватель с фокусировкой солнечной энергии
Центральные энергетические станции, работающие на солнечной энергии, имеют, обычно, несколько тысяч зеркал-отражателей, для того чтобы улавливать солнечную энергию с большой площади. Все отражатели направляют солнечные лучи на верхушки центральной башни, куда непрерывно поступает холодная вода через систему трубопроводов. Под воздействием излучения вода очень быстро закипает превращаясь в пар, который под давлением вращает лопасти турбин. Электростанции такого типа успешно действуют в США, Японии и некоторых странах Европы.
Большое количество научных экспериментов и тонких технологий требуют подчас создания огромной температуры. Идеальный вариант - солнечная энергия, способная создавать гигантские температуры на небольшой площади. Самая известная "солнечная печь" действует во французском местечке Одило. Ее подвижные зеркала концентрируют энергию солнца с большой площади на площадке менее одного квадратного метра. Эта площадка находится на небольшой башне перед системой зеркал. В ясные дни в фокусе зеркал удается достигнуть температуры в 3300°С. С ее помощью в Одило создают материалы с особенными свойствами, которые невозможно получить в традиционной металлургии.

Рис.6. Солнечная печь
Элементы солнечной батареи
Модули солнечной батареи наземного применения как правило конструируются для зарядки свинцово-кислотных аккумуляторных батарей с номинальным напряжением 12В. При этом последовательно соединяются 36 солнечных элементов, и далее собираются в модуль. Полученный пакет как правило обрамляют в алюминиевую раму, облегчающую крепление к несущей (опорной) конструкции. Мощность модулей солнечной батареи может достигать 10-300Вт.
Электрические параметры таких модулей отражаются в вольтамперной характеристике, определенной при стандартных условиях (т.е. когда мощность солнечной радиации равняется 1000 Вт/м2, температура элементов - 25°С и солнечный спектр - на широте 45°) (рисунок 1). Точка пересечения кривой с осью напряжения называется напряжением холостого хода Vх.х., а с осью тока - током короткого замыкания Iк.з. На этом же графике приведена кривая мощности, получаемой от солнечных элементов в зависимости от нагрузки. Номинальная мощность модуля определяется как наибольшая мощность при стандартных условиях. Значение напряжения, соответствующее максимальной мощности именуется рабочим напряжением Vр, а соответствующий ток - рабочим током Iр. Значение рабочего напряжения для модуля, состоящего из 36 элементов примерно равно 16-17В (0,45-0,47В/элемент) при 25°С. Такой запас по напряжению нужен для того, чтобы компенсировать уменьшение рабочего напряжения при разогреве модуля солнечным излучением. Температурный коэффициент напряжения холостого хода для кремния составляет - минус 0,4%/градус. Температурный коэффициент тока - плюс 0,07 %/градус. Напряжение холостого хода солнечного модуля мало меняется при изменении освещенности, в то время как ток короткого замыкания прямо пропорционален. КПД солнечного модуля определяется как отношение максимальной мощности модуля к общей мощности излучения, падающей на его поверхность при стандартных условиях, и составляет 15-40%.
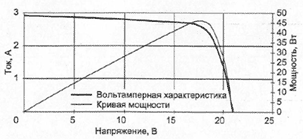
Рис.1. Вольтамперная характеристика солнечной батареи
С целью получения требуемой мощности и рабочего напряжения модули соединяют последовательно или параллельно. Так получают солнечную батарею. Мощность солнечной батареи всегда ниже, чем сумма мощностей модулей - из-за потерь, обусловленных различием в характеристиках однотипных модулей (потерь на рассогласование). Чем тщательнее подобраны модули в батарее (то есть, чем меньше различие в характеристиках модулей), тем ниже потери на рассогласование. К примеру, при последовательном соединении десяти модулей с разбросом характеристик 10% потери составляют примерно 6%, а при разбросе 5% - снижаются до 2%.
В случаи затенения одного модуля, или части элементов в модуле, в солнечной батарее при последовательном соединении появляется "эффект горячего пятна" - затененный модуль (или элемент) начинает рассеивать всю производимую освещенными модулями (или элементами) мощность, стремительно нагревается и выходит из строя. Для устранения этого эффекта параллельно с каждым модулем (или его частью) устанавливают шунтирующий диод. Диод нужен при последовательном соединении более двух модулей. К каждой линейке (последовательно соединенных модулей) также подключается блокирующий диод для выравнивания напряжений линеек. Все эти диоды как правило размещаются в соединительной коробке самого модуля. Схема батареи приведена на рисунок 2.
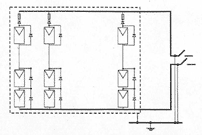
Рис.2. Схема диодов в солнечной батареи
Вольтамперная кривая солнечной батареи имеет тот же вид, что и единичного модуля. Рабочая точка батареи, подключенной к нагрузке, не всегда совпадает с точкой максимальной мощности (тем более, что положение последней зависит от условий освещенности и температуры окружающей среды). Подключение таких нагрузок, как, например, электродвигатель, может сдвинуть рабочую точку системы в область минимальной или даже нулевой мощности (и двигатель просто не запустится). Вследствие этого следующий важный компонент солнечной батареи - преобразователи напряжения, способные согласовывать солнечную батарею с нагрузкой. Общая схема солнечной электростанции имеет показана на рисунках 3 и 4 .
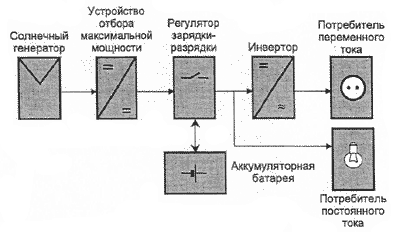
Рис.3. Схема автономной солнечной электростанции
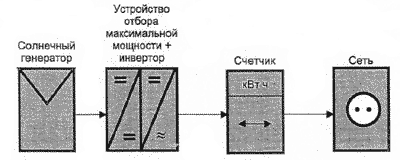
Рис.4. Схема солнечной электростанции объединенной с промышленной электросетью
Регуляторы отбора мощности батареи
Обычно, в этих регуляторах реализуется принцип поиска максимума мощности путем коротких периодических изменений положения рабочей точки. Если при этом мощность на выходе прибора возрастает, то положение рабочей точки меняется в этом направлении при последующем шаге. Таким образом непрерывно оптимизируется нагрузочная характеристика для отбора максимальной мощности, а также обеспечивается возможность регулировки в широком динамическом диапазоне и формирования импульсов тока, способных зарядить аккумуляторную батарею даже в условиях слабой освещенности. Этот достаточно простой алгоритм может быть улучшен запоминанием часто повторяющихся направлений смещения рабочей точки (для устранения шагов смещения в ложных направлениях), что бывает важно в условиях быстро меняющейся освещенности. На выходе регулятора формируются импульсы постоянного тока, ширина и частота следования которых зависят от мощности, производимой солнечной батареей в данный момент. При этом, если рабочее напряжение нагрузки ниже, чем рабочее напряжение модуля, то можно получать большие значения токов в нагрузке, чем ток короткого замыкания батареи. Нужно учитывать, что регуляторы имеют КПД 0,85-0,95.
Аккумуляторные в системе солнечной батареи
Выработанную солнечной батареей энергию можно сохранять в разных формах:
• химическая энергия в электрохимических аккумуляторах;
• потенциальная энергия воды в резервуарах;
• тепловая энергия в тепловых аккумуляторах;
• кинетическая энергия вращающихся масс или сжатого воздуха.
Для солнечных батарей больше подходят электро-аккумуляторы, так как солнечные батареи производят, а потребитель потребляет электроэнергию, которая непосредственно и запасается в аккумуляторе. Исключение - солнечные станции для водоснабжения, где потребляется вода, а энергия запасается в потенциальной энергии воды в водонапорной башне.
В большинстве фотоэлектрических систем применяют свинцово-кислотные аккумуляторы. Нужно сразу подчеркнуть, что аккумуляторы специально предназначенные для солнечных батарей (и других подобных систем), существенно отличаются от стартерных автомобильных аккумуляторов, пусть даже имеющих в основе туже технологию.
Главными условиями по выбору аккумуляторов являются:
• стойкость к циклическому режиму работы;
• способность переносить без последствий глубокий разряд;
• низкий саморазряд аккумулятора;
• некритичность к нарушению условий зарядки и разрядки;
• долговечность;
• простота в обслуживании;
• компактность и герметичность (важный критерий для переносных или периодически демонтируемых солнечных батарей).
Этим требованиям в полной мере удовлетворяют аккумуляторы, изготовленные по технологиям "dryfit" и AGM (адсорбированный электролит) или рекомбинационной технологии. Они характеризуются отсутствием эксплуатационных затрат и перекрывают диапазон емкостей 1-12000 А•ч, что позволяет удовлетворять требованиям всех потребителей. Эти аккумуляторы отличаются пониженным газовыделением и рекомбинацией кислорода. Вследствие этого вода электролита не электролизуется и не испаряется, и такие аккумуляторы не требуют доливки электролита. К примеру, аккумуляторы одной из фирм с трубчатыми положительными пластинами, имеют следующие характеристики:
• большой срок службы -15 лет;
• стойкость к циклическому режиму - более 1200 циклов;
• отсутствие необходимости обслуживания в течение всего срока службы;
• минимальное газовыделение (благодаря применению сплава без сурьмы и использованию технологии внутренней рекомбинации газа);
• саморазряд - примерно 3% в месяц.
Вследствие высокой стоимости таких аккумуляторов, появляется желание использовать обычные стартерные свинцово-кислотные аккумуляторные батареи (автомобильный аккумулятор). Срок службы таких аккумуляторов в составе солнечной батареи - не более 3-5 лет. Вследствие этого за срок использования солнечной батареи (15-20 лет и более) необходимо будет менять аккумуляторы (к этому добавятся затраты на обслуживание аккумуляторов и оборудование помещений).
С целью получения требуемого рабочего напряжения аккумуляторы или аккумуляторные батареи соединяют последовательно. При этом следуют определенным првилам:
• используют аккумуляторы только одного типа, произведенные одним изготовителем;
• эксплуатируют все аккумуляторы одновременно, не делая отводов от отдельных аккумуляторов составляющих аккумуляторную батарею;
• не объединяют аккумуляторы с разницей в дате выпуска более чем на месяц в одну аккумуляторную батарею;
• обеспечивают разницу температур отдельных аккумуляторов не более 3°С.
Ради продления срока службы аккумуляторов при циклическом режиме работы в солнечных батареях важно не допускать глубокого разряда. Уровень разряда характеризуется глубиной разряда, которая выражается в процентах от номинальной емкости аккумулятора. На рисунке 5 изображена зависимость емкости аккумулятора (в процентах от номинальной) от количества отработанных циклов при различной глубине разряда (аккумуляторы FIAMM GS). Таким образом, эксплуатация аккумуляторов при глубоком разряде ведет к их более частой замене и, соответственно, к удорожанию системы. Глубину разряда аккумуляторов солнечных батарей стараются ограничить на уровне 30-40%, что достигается отключением нагрузки (или снижением мощности) либо использованием аккумуляторов большей емкости.
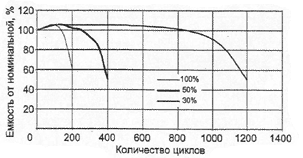
Рис.5. Зависимость емкости аккумулятора от количества отработанных циклов при различной глубине разряда
Вследствие этого, для управления процессом зарядки и выбора оптимального режима, в состав солнечной электростанции обязательно включают контроллеры зарядки-разрядки аккумуляторной батареи.
Регуляторы зарядки и разрядки аккумуляторов
Стоимость регулятора заряда составляет не выше 5% от стоимости всей системы (однако от качества зарядных регуляторов зависит то, как часто придется менять аккумулятор). Чтобы предохранить батарею от избыточной разрядки, нагрузка должна быть отключена, когда напряжение батареи опускается ниже напряжения отключения. Нагрузка не должна подключаться до момента, когда напряжение не возрастет до определенного значения (напряжения подключения). Имеются довольно противоречивые стандарты этих значений. Они зависят от конструкции определенных батарей, производственного процесса и срока службы аккумуляторных батарей. В некоторых моделях регуляторов применяется звуковой сигнал, который сообщает пользователю о скором отключении питания.
Чтобы защитить батарею от перезарядки надо ограничить зарядный ток при достижении напряжения завершения зарядки. Напряжение начнет снижаться, пока не достигнет другого порога, называемого напряжением возобновления заряда. Небольшие солнечные электростанции имеют склонность к перепотреблению энергии (а не к перезарядке) вследствие этого допускается перезарядка, и при этом нужно применять более высокое напряжение завершения заряда.
Выше изложенное относится к регуляторам для автономных солнечных электростанций небольшой мощности (до 1кВт). У более мощных системах солнечных батарей функции контроля зарядки и разрядки берет на себя системный контроллер (управляющий также всей системой). Как правило это устройство сопряжено с компьютером (осуществляющим к тому же постоянный мониторинг за работой элементов с записью значений освещенности, температуры, тока и напряжения для дальнейшего анализа).
Инверторы
Солнечный генератор (каким бы сложным и большим он не был) может вырабатывать лишь постоянный ток. К счастью, имеется много потребителей, использующих именно постоянный ток (зарядка аккумуляторов, освещение, радиоаппаратура и т.д.), но потребителей переменного напряжения 220В ни меньше. Для преобразования постоянного тока аккумуляторной батареи в переменный синусоидальной формы, нужен инвертор.
Инверторы - полупроводниковые приборы. Они могут быть поделены на два типа в соответствии с типом фотоэлектрических систем:
• инверторы для автономных систем солнечных батарей;
• инверторы для сетевого использования.
Выходной каскад у обоих типов во многом похож, а основное отличие в схеме управления. Первый тип имеет генератор частоты, а второй должен работать синхронно с промышленной сетью (и в качестве генератора частоты использует саму сеть).
Для всех типов ключевой параметр - КПД (который должен быть более 90%). Выходное напряжение автономных инверторов как правило составляет 220В (50/60 Гц), а в инверторах мощностью 10-100кВт можно получать трехфазное напряжение 380В. Все автономные инверторы трансформируют постоянный ток аккумуляторных батарей. Вследствие этого входное напряжение выбирается из ряда 12, 24, 48 и 120В. Чем больше входное напряжение, тем проще инвертор и тем выше его КПД. При больших напряжениях существенно меньше потери на передачу энергии от солнечного генератора к аккумуляторной батарее, регулятору зарядки и инвертору, однако при этом усложняется конструкция солнечной электростанции и ее эксплуатация при опасных напряжениях (выше 40 В). К форме выходного сигнала автономных инверторов предъявляются менее жесткие требования. В ряде случаев (если позволяет нагрузка) возможно использование инверторов с трапециевидным выходным сигналом. Такие инверторы стоят в 2-3 раза дешевле инверторов с синусоидальным выходным сигналом. Важный параметр автономных инверторов - зависимость КПД от мощности подключенной нагрузки. КПД не должен значительно снижаться при подключении нагрузки в десять раз меньшей (по потребляемой мощности), чем номинальная мощность инвертора. Вместе с тем инвертор должен выдерживать перегрузки в выходных цепях (при подключении электродвигателей и прочих динамичных нагрузок). Таким образом, к автономному инвертору предъявляются следующие требования:
• способность переносить без последствий перегрузки (как кратковременные, так и длительные);
• маленькие потери при малых нагрузках и на холостом ходу;
• стабилизация выходного напряжения;
• низкий коэффициент гармоник;
• высокий КПД;
• отсутствие помех на радиочастотах.
Иностранные фирмы предлагают широкий ассортимент инверторов, специально разработанных для солнечных батарей. Такие инверторы уже имеют блок регулятора отбора максимальной мощности, блок регулятора заряда, а также дополнительный вход подключения дизель-генератора (для экстренной подзарядки аккумуляторной батареи).
К выходному сигналу сетевых инверторов предъявляются наиболее жесткие требования. Для понижения потерь на преобразование такие инверторы работают при высоких входных напряжениях. Поскольку их входные цепи запитываются напрямую от солнечной батареи, инверторы имеют регулятор отбора максимальной мощности (встроенный в инвертор). Сетевые инверторы имеют также блок контроля мощности солнечной батареи (и включаются автоматически, как только мощность солнечной батареи становится достаточной для формирования переменного сигнала).
Еще в Древнем Египте за три с половиной тысячи лет до нашей эры применялись ветровые двигатели для подъема воды и размола зерна. За пятьдесят с лишним веков ветряные мельницы почти не изменили свой облик. Например, в Англии имеется мельница, построенная в середине XVII в. Несмотря на свой преклонный возраст, она исправно трудится и по сей день. В России до революции насчитывалось приблизительно 250 тыс. ветряных мельниц, общая мощность которых составляла около 1,5 млн. кВт. На них размалывалось до 3 млрд. пудов зерна в год.
Рис.1. Персидская ветряная мельница

Рис.2. Греческая ветряная мельница
Появлением ветряных мельниц, была облегчена одна из самых тяжелых крестьянских работ - вращение тяжелых каменных жерновов, перетирающих зерно в муку. Теперь это делал ветер, крутя крылья мельницы. Одна из первых ветряных мельниц была найдена в Персии - в ней крылья были насажены на ту же ось, что и жернова. Всем была хороша персидская мельница, но вот беда - она могла работать лишь при сильном устойчивом ветре. Когда его порывы стихали, вращать жернова приходилось по старинке - с помощью быков, а то и рабов. И вот, приблизительно шестьсот лет назад, началось строительство мельниц башенного типа с огромными крыльями, расположенными горизонтально к поверхности земли. Одна из первых таких мельниц появилась в Голландии, издавна славившейся изобретательными мастерами. В 1745 году некий Эдмунд Ли осчастливил мельников изобретением нового типа крыльев - деревянных каркасов, обтянутых материей. Выдумка оказалась настолько удачной, что применяется в ветряных мельницах и сейчас.
Рис.3. Ветряная мельница Эдмунда Ли
Ветряные мельницы оказались прекрасными источниками даровой энергии. Неудивительно, что со временем их стали использовать не только для размола зерна. Ветряки вращали дисковые пилы на больших лесопилках, поднимали грузы на большие высоты, использовались для подъема воды. Наряду с водяными мельницами они оставались, практически, самыми мощными машинами прошлого. В той же Голландии, например, где ветряков было больше всего, они успешно работали до середины нашего века. Часть их действует и в настоящее время.
Что интересно, мельницы в средневековье вызывали у некоторых суеверный страх - настолько непривычными были даже простейшие механические приспособления. Мельникам приписывали общение с нечистой силой.
Время шло, и люди все чаще задумывались о ветре как о источнике бесплатной энергии. Наступил такой этап развития технологии, когда стали строить электрогенераторы. И в Дании в 1890 году построили первый ветрогенератор для производства электричества. Такие ветрогенераторы устанавливались в труднодоступных местах, куда было неудобно или невыгодно передавать ток с обычных электростанций. В конце концов, ветровые турбины стали давать четверть всей нужной датской промышленности энергии. Между 1920 и 1930 годами ветровые генераторы стали появляться в Австралии и США. В 1937 году в Крыму была построена крупнейшая в мире, как говорили тогда, ветроэлектрическая станция. Она действительно была внушительных размеров, но ток, который ветрогенератор давал в электрическую сеть Севастополя, мощностью своей не превышал 100 кВт.

Рис.4. Ветрогенератор в Калифорнии
Типы ветрогенераторов
Разработано большое количество ветрогенераторов. В зависимости от ориентации оси вращения по отношению к направлению потока ветрогенераторы могут быть классифицированы следующим образом (рисунок 5-7):
• с горизонтальной осью вращения, параллельной направлению ветрового потока;
• с горизонтальной осью вращения, перпендикулярной направлению ветра (подобные водяному колесу);
• с вертикальной осью вращения, перпендикулярной направлению ветрового потока.
Рис.5. Ветрогенераторы с горизонтальной осью вращения
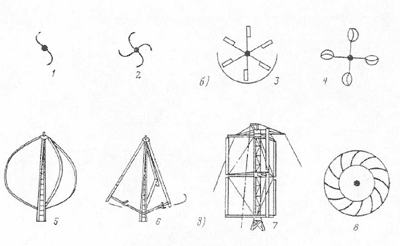
Рис.6. Ветрогенераторы с вертикальной осью вращения с использованием силы сопротивления и подъемной силы
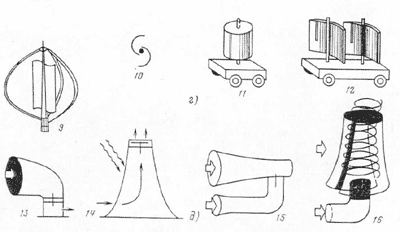
Рис.7. Ветрогенераторы других типов
Разработаны также устройства для преобразования энергии ветра в электроэнергию без применения движущихся частей. К ним относится, например, устройство, в котором для выработки электрической энергии на основе термоэлектрического эффекта Томсона применяется процесс охлаждения в ветровом потоке.
Ветрогенераторы с горизонтальной осью вращения
Ветрогенераторы с горизонтальной осью вращения могут использовать для преобразования энергии ветра подъемную силу или силу сопротивления. Устройства, использующие подъемную силу, предпочтительнее, поскольку они могут развить в несколько раз большую силу, чем устройства с непосредственным действием силы сопротивления. Последние, кроме того, не могут перемещаться со скоростью, превышающей скорость ветра. Вследствие этого лопасти, на которые действует подъемная сила (ветроколеса), могут быть более быстроходными (быстроходность - отношение окружной скорости элемента поверхности к скорости ветра) и иметь лучшее соотношение мощности и массы при меньшей стоимости единицы установленной мощности.
Ветроколесо может быть выполнено с различным количеством лопастей; от однолопастных ветрогенераторов с контргрузами до многолопастных (с числом лопастей до 50 и более). Ветроколеса с горизонтальной осью вращения выполняют иногда фиксированными по направлению, т.е. они не могут вращаться относительно вертикальной оси, перпендикулярной направлению ветра. Такой тип ветрогенераторов используется лишь при наличии одного, господствующего направления ветра. В большинстве же случаев система, на которой укреплено ветроколесо (так называемая головка), выполняется поворотной, ориентирующейся по направлению ветра. У малых ветрогенераторов как правило применяются для этой цели хвостовые оперения, у больших - ориентацией управляет электроника.
Для ограничения частоты вращения ветроколеса при большой скорости ветра используется ряд методов, в том числе установка лопастей во флюгерное положение, использование клапанов, установленных на лопастях или вращающихся вместе с ними, а также устройства для вывода ветроколеса из-под ветра с помощью бокового плана, расположенного параллельно плоскости вращения колеса.
Лопасти могут быть непосредственно закреплены на валу генератора, или же вращающий момент может передаваться от его обода через вторичный вал к генератору, или другой рабочей машине.
Из рисунка 8 видно, как установленная мощность Руст, развиваемая ветроколесом с горизонтальной осью вращения, зависит от его размеров.
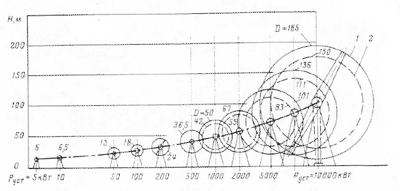
Рис.8. Мощности ветрогенераторов различных размеров при скорости ветра 7,6 м/с
Перпендикулярное направление действия ветра на установки с горизонтальной осью вращения оказалось малоэффективным, так как также требует использования систем ориентации и сравнительно сложных методов съема мощности, что ведет к потере их эффективности. Они не имеют преимуществ по сравнению с другими типами ветродвигателей с горизонтальной и вертикальной осью вращения.
Ветрогенераторы с вертикальной осью вращения
Такие роторы имеют важные преимущества перед ветрогенераторами с горизонтальным расположением оси. Для них отпадает необходимость в устройствах для ориентации на ветер, упрощается конструкция и уменьшаются гироскопические нагрузки, вызывающие дополнительные напряжения в лопастях, системе передач и прочих элементах установок с горизонтальной осью вращения.
К таким установкам относятся устройства с пластинами, чашеобразными или турбинными элементами, а также роторами Савониуса с лопастями S-образной формы, на которые действует также и подъемная сила. Устройства такого типа обладают большим начальным моментом, однако меньшими быстроходностью и мощностью по сравнению с обычным ротором.
В 1920 г. во Франции Дарье предложил новый тип ротора, интенсивной разработкой которого начали заниматься с 1970 г. Сейчас ветрогенератор Дарье может рассматриваться в качестве основного конкурента ветрогенераторов крыльчатого типа.
Ротор Дарье относится к ветрогенераторам, использующим подъемную силу, которая появляется на выгнутых лопастях, имеющих в поперечном сечении профиль крыла. Ротор имеет сравнительно небольшой начальный момент, и большую быстроходность, в силу этого - относительно большую удельную мощность, отнесенную к его массе или стоимости. Такие роторы имеют различную форму (?-, ?-, ?- и ромб-образную) с одной, двумя или большим числом лопастей.
Крылья пропеллера должны быть легкими и в то же время достаточно прочными. Они делаются из дерева, стали или искусственных материалов - таких как фиберглас.
Современные ветрогенераторы конечно, более производительны чем ветряки. Количество вырабатываемого ими электричества зависит от силы ветра и площади лопастей пропеллеров. Например, увеличивая вдвое площадь лопастей, можно получить вчетверо больше электричества.
Малые и средние ветровые турбины как правило снабжают электричеством острова или небольшие отдаленные поселения. В США, например, ветрогенератор на острове Каттиханк Айлэнд, расположенном неподалеку от побережья штата Массачусетс, вырабатывает достаточно энергии для снабжения двухсот человек - всего населения острова. В нашей стране ветрогенераторы применяются, в основном, на севере - на Кольском полуострове, в Якутии и даже на антарктических научных станциях.
Сегодня в США, Великобритании, Дании и Канаде производятся ветровые турбины мощностью 1 МВт электроэнергии (этого хватает, чтобы мгновенно вскипятить 500 чайников). Самые большие ветрогенераторы в мире - английская LS-1 на острове Оркни и американская MOD5-B на Гавайских островах. Лопасти английской турбины имеют размах 60 метров, она производит приблизительно 3 МВт электроэнергии. Американская еще больше: размах лопастей 96 метров.
Однако вряд ли ветровая энергетика будет развиваться по пути гигантизма. Скорее, будущее принадлежит средним турбинам, более удобным в производстве и эксплуатации. Как бы ни были велики и мощны современные ветрогенераторы, они пока не могут полностью обеспечить потребности крупных городов. Небольшие ветровые электростанции успешно действуют во многих странах мира. В США, например, где множество ферм и малых городов расположено в труднодоступной местности, всячески поощряется строительство ветрогенератор в 1,5 киловатта. На одном из Северо-Фризских островов в Германии уже много лет работает установка для опреснения морской воды, а на острове Пельворм даже создан полигон для испытаний разных моделей ветроустановок. В нашей стране ветрогенераторы малой мощности успешно применяются в южных животноводческих хозяйствах для механизации подъема воды. Практика показала, что использование их обходится в 4 раза дешевле, чем использование дизельных двигателей, и в 10 раз дешевле подвоза воды автомобилями.
Непостоянство силы ветра требует надежной аккумуляции (сохранения) энергии на периоды затишья. Однако существующие аккумуляторы электроэнергии очень дороги и могут работать с хорошей отдачей лишь с малыми ветрогенераторами. Вследствие этого энергию ветра лучше аккумулировать в самом продукте, который она производит, - в смолотой муке, измельченных кормах, воде, наполнившей водонапорную башню. Все это повышает ценность применения ветровой энергии именно в сельском хозяйстве.
Одно из достоинств ветроусгановок заключается в том, что они действуют как бы в унисон с нашими потребностями. В большинстве регионов земного шара наиболее сильные ветра дуют осенью и в начале зимы - как роз тогда, когда человек больше всего нуждается в свете и тепле. И наоборот, времена затишья - в основном летом - совпадают с периодами сокращения потребления энергии (мы говорим, разумеется, о бытовом потреблении). Но это и другие достоинство выглядят бледновато по сравнению с основным недостатком: чтобы увеличить мощность ветроустановки, надо наращивать размер лопастей, то есть, утяжелять конструкцию. Однако тогда для работы ветрогенератора потребуется еще большая скорость ветра, а значит, сузятся районы применения установки. Заколдованный круг.
Ветрогенераторы и окружающая среда
Сегодня, когда экологические проблемы постепенно становятся одной из главных забот человечества, использование разных источников энергии рассматривается не только с точки зрения их мощности и экономичности, но и влияния на окружающую среду.
На первый взгляд ветровая энергия абсолютно чиста экологически и не наносит ущерба природе и людям. Но это не совсем так. Мощные ветровые электростанции с сотнями и тысячами ветровых турбин приносят немало проблем: они производят невообразимый шум, могут служить помехой для радио- и телетрансляций. Кроме того, огромные вышки нередко препятствуют миграции птиц. Разумеется, по сравнению с тем огромным ущербом природе, который наносят тепловые электростанции, вред от ветрогенераторов почти незаметен, однако если мы хотим в будущем иметь абсолютно "чистую" энергетику, проблемы влияния ветроустановок на окружающую среду надо решать уже сейчас. Одним из таких решений - и наиболее перспективным - является установка ветрогенераторов в открытом море, на большом удалении от берегов. Это повысит не только безопасность, но и экономичность, так как на просторах Мирового океана ветры дуют с особой силой. Разумеется, установка ветрогенераторов в открытом море требует больших затрат, однако экологическая чистота стоит денег, затраченных на нее.
Первая ветряная электростанция в открытом море уже действует. Это установка Эбельтофф в Дании. 16 ее турбин производят 55 кВт электроэнергии - вполне хватает для полного снабжения поселка из 600 домов. Специалисты подсчитали, что только Западная Европа, береговая линия которой протянулась более чем на 20000 километров, в состоянии получать около триллиона киловатт-часов электроэнергии в год, если воздвигнуть ветрогенераторы вблизи от побережья. А возможности нашей страны в этом плане еще выше.
На сегодняшний день технология строительства платформ для ветрогенераторов в открытом море отработана (большую роль здесь сыграл опыт строительства морских скважин для добычи нефти) и уже применяется.
Как уже опмечалось, главной проблемой применения ветровой энергии является непостоянство ветра. Имеется несколько способов аккумулировать энергию на случай безветренных дней. Простейший из них - создать систему двух резервуаров, один из которых залегает ниже другого. В ветреные дни производимое электричество можно использовать для закачки воды из нижнего резервуара в верхний. А когда ветрогенератор бездействует, достаточно открыть перемычку - и вода устремится из верхнего резервуара в нижний, вращая по пути турбину, которая будет давать электроэнергию. Еще один способ аккумулирования - использование ветровой энергии для электролиза воды - получения водорода и кислорода из воды. Водород - идеальное топливо, которое может заменить любой тип горючего. Теплота его сгорания втрое выше, чем у бензина. Если в ветреные дни создать достаточный запас водорода, его можно транспортировать в любое место по газопроводам, а затем использовать в топливных элементах.
Ученые подсчитали, что общий ветроэнергетический потенциал земли приблизительно в 30 раз превосходит годовое потребление электричества во всем мире. Разумеется, весь этот запас энергии использовать не удастся. Для нормальной роботы ветроустсновок скорость воздушных потоков не должна в среднем за год падать меньше 4-5 м/с, и в то же время не должна превышать 50 м/с. Впрочем, максимальная скорость ветра может быть и выше. Американские инженеры создали генератор с вертикальными роторами, которые вращаются наподобие карусели. По своей эффективности он превосходит лопастные генераторы почти втрое и способен выдерживать даже ураганные ветры. Видимо, с развитием технологии появятся и более совершенные конструкции. Скорее всего, технология не пойдет по пути повышения размеров ветроустановок. Будущее принадлежит ветрогенераторам мощностью от 5 до 100 киловатт, которые будут обеспечивать нужды сельского хозяйства и небольших поселений. Впрочем, имеется возможность применения и более мощных (до 5 мегаватт) установок, которые будут вырабатывать электроэнергию в составе уже существующих энергетических систем. Кроме того, ветровая энергия может быть использована для производство удобрений, для получения сжатого воздуха, который будет направляться в водоемы для их аэрации - повышения содержания кислорода, необходимого для его обитателей. Разные отросли промышленности все активнее делают заявки на ветровую энергию.
P.S.
Что же такое ветер? Можно ли применять его энергию и рассчитывать на его помощь, если это едва ли не самое неустойчивое и мало предсказуемое явление природы? Как он зарождается, куда направлен, можно ли на него "положиться"? Ведь от того, насколько постоянна его природа, зависит эффективность работы любой ветроэнергетической установки.
Под лучами Солнца от нагретой поверхности Земли нагревается и воздух. Интенсивность его нагрева завсит в основном от состояния и свойств земной поверхности Так например, воздух в пустыне от раскаленного песка получает в 130 раз больше тепла, чем от морской поверхности на той же широте. Нагретый воздух уменьшает свою плотность - меняется атмосферное давление, при повышении температуры оно падает, при понижении - наоборот. Массы воздуха с большим давлением Двигаются туда, где давление ниже, появляется ветер. На широте экватора вследствие сильного нагрева поверхности Земли образуется устойчивая зона пониженного давления. В нее стекаются воздушные массы с севера и юга - создаются постоянные ветры одного преимущественного направления - пассаты. Под действием вращения Земли они немного отклоняются, в Северном полушарии вправо по ходу воздушных масс, в Южном - влево.
На высоте 5-7 км дуют ветры обратного направления - антипассаты. К северу и югу от экватора есть довольно узкая зона устойчивого затишья. Приблизительно на широте 30 градусов по обе стороны от экватора наблюдаются вторые зоны затишья, куда притекают и опускаются холодные потоки с экватора, прошедшие на высоте нескольких километров, - антипассаты. Появляется зона высокого давления, здесь зарождаются пассаты. Из этой же области дуют ветры по направлению к полюсам, так называемые преобладающие западные. По сравнению с пассатами они существенно более изменчивы. Это полоса между 30 и 60° к северу и югу издавна имеет худую славу у моряков и прозвана ревущими сороковыми. Район Бермудских островов на широте 30 , находящийся в зоне затишья, иногда называется конскими широтами. Это странное и немного мрачное название сохранилось со времен парусного флота. Многие корабли того времени перевозили из Европы в Вест-Индию лошадей. Попадая в зону безветрия, суда лишались возможности двигаться, обвисали паруса, таяли запасы пресной воды и продовольствия. Прежде всего при этом погибали лошади. Выброшенные за борт, их трупы еще долго носились по волнам.
На полюсах вследствие сильного охлаждения есть еще две области высокого давления, из которых к экватору дуют устойчивые полярные восточные ветры.
Под действием солнечных лучей суша нагревается и охлаждается быстрее, чем вода, вследствие этого в различное время года на побережьях морей и океанов образуются сезонные ветры, дующие на берег или с берега, - муссоны.
Итак, оказывается, ветры - явление не такое уж стихийное, как это может показаться с первого взгляда. На их постоянство можно рассчитывать, их энергию можно использовать, не боясь, что в один прекрасный, а точнее, совсем не прекрасный момент они исчезнут вовсе.
На земном шаре имеются огромные пространства, над которыми дуют ветры с постоянным преимущественным направлением и примерно одинаковой силой. Наша страна вследствие своего географического положения в этом плане находится в выгодных условиях. Она обладает неисчерпаемыми ресурсами энергии ветра. Имеются огромные области в России, где применять энергию ветра можно с максимальной эффективностью. Применять. Например, побережье Северного Ледовитого океана от Кольского полуострова до Чукотки, севернее приблизительно шестьдесят седьмой параллели, и Камчатка. Длительность действия ветра в этих районах приблизительно 300-320 суток в году.
Какие же препятствия стоят на пути широкого использования ветра? Их в основном два: непостоянство его направления и силы и необходимость аккумулирования энергии на случай отсутствия ветра или малой его мощности. Прежде всего, видимо, надо рассматривать ветроэнергетические установки как один из путей получения дополнительной энергии, позволяющей сократить расход органического топлива.
Источники бесперебойного питания, согласно действующим стандартам, классифицируют по принципу действия на три основные группы:
Off-Line/Stand-By/back-up UPS;
Line-Interactive;
On-Line.
Источники бесперебойного питания типа Off-Line
Источники бесперебойного питания типа Off-Line стандартом определяются как пассивные, резервного действия (UPS-PSO). В нормальном режиме функционирования штатным питанием нагрузки является отфильтрованное напряжение первичной сети при допустимых отклонениях входного напряжения и частоты. В случаи, когда параметры входного напряжения выходят за значения настроенных диапазонов, включается инвертор источника бесперебойного питания, обеспечивающий непрерывность питания нагрузки. Инвертор питается от аккумуляторов.
Это наиболее простые ИБП (рисунок 1), а значит, и самые дешевые. Источник бесперебойного питания состоит из двух параллельных ветвей:
• фильтр-нагрузка;
• выпрямитель-батарея-инвертор-нагрузка.
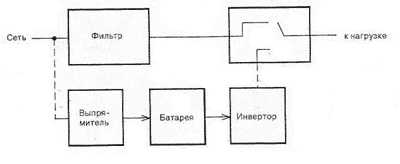
Рис.1. Схем источника бесперебойного питания Stand-By типа
При нормальных характеристиках сети, напряжение в нагрузку поступает через фильтр, фильтрующий всевозможные помехи. Это, обычно, фильтр-ограничитель (surge suppressor), хотя может быть и фильтр-стабилизатор (line conditioner) либо их сочетание, а также статический переключатель.
Одновременно через выпрямитель подзаряжаются и аккумуляторы аккумуляторной батареи. При пропадании, завышении либо понижении входного напряжения, питание нагрузки электронным переключателем переключается на батарейное через инвертор (инвертор преобразует постоянное напряжение в переменное). Переключатель обеспечивает время переключения от 2 до 15 мс. Отметим, что пропадание электроэнергии в ходе этого времени не оказывает сколь-нибудь заметного влияния на компьютерные системы, которые спокойно переносят отключение питания на 10-20мс. Учитывая, что почти у всей современной аппаратуры блоки питания импульсные, переключение совершается незаметно для пользователя. Источники бесперебойного питания такого типа могут поддержать работу персонального компьютера в ходе 5-10 мин.
Основные недостатки ИБП Off-Line
Главными недостатками ИБП off-line считают:
• плохая работа источников питания этого типа в сетях с низким качеством электрической сети: плохая защита от провалов напряжения (sags), превышений допустимого значения напряжения, изменений частоты и формы входного напряжения;
• невозможность своевременного восстановления емкости аккумуляторов при частых переключениях на батарейное питание;
• несинусоидальное выходное напряжение при питании от аккумуляторной батареи.
Итак, основное рекомендуемое использование источников бесперебойного питания off-line типа - устройство защиты нагрузки с импульсным блоком питания с редкими отклонениями в питающей сети.
Источники бесперебойного питания типа Line-Interactive
В источниках бесперебойного питания линейно-интерактивного типа (Line-Interactive, иногда Ferroresonant) сочетаются преимущества типа On-line с надежностью и эффективностью резервных (standby). В источниках бесперебойного питания этого типа в отличие от технологии Off-line в прямую цепь включен ступенчатый автоматический регулятор напряжения (booster), построенный на основе автотрансформатора (трансформатор с переключающимися обмотками). В некоторых моделях применяется сетевой стабилизатор напряжения.
Инвертор связан с нагрузкой. При работе он питает нагрузку параллельно стабилизированному (conditioned) переменному напряжению сети. Нагрузка подключается полностью лишь в том случае, когда входное напряжение электросети пропадает.
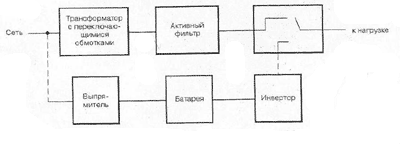
Рис.2. Схем источника бесперебойного питания Line-Interactive типа
Из-за такого взаимодействия ("interaction") со входным сетевым напряжением данная архитектура и получила свое название. В определенном диапазоне изменения сетевого напряжения, выходное напряжение поддерживается в заданных границах за счет переключения обмоток трансформатора либо стабилизатором. Инвертор как правило работает при низком напряжении, регулирует выходное напряжение и подзарядку аккумуляторов до тех пор, пока не потребуется его включение для полного питания нагрузки при перебоях в электросети. Линейно-интерактивные источники бесперебойного питания нашли наиболее широкое применение в системах защиты компьютерных сетей.
Трансформатор, сделанный по специальной так называемой ferro-технологии, сглаживает скачки напряжения, при этом источник бесперебойного питания реже переключается на работу от аккумуляторной батареи, и следовательно повышается срок службы батареи. Обычно, эти источники бесперебойного питания оборудованы совершенными фильтрами, обеспечивающими защиту от помех различного происхождения. Типовое время переключения в режим питания от аккумуляторов или обратно составляет 2 мс.
Конструктивно трансформатор на имеет несколько дополнительных отводов во вторичной обмотке (это может быть автотрансформатор с единственной обмоткой), переключением отводов трансформатора при изменениях входного напряжения управляет контроллер (микропроцессор), поддерживая напряжение на выходе в требуемом диапазоне. Итак, Line-Interactive источник бесперебойного питания работает по принципу управляемого ЛАТРа и действительно реже переключается на батарейное питание при скачках входного напряжения. В этой схеме зарядное устройство конструктивно совмещено с преобразователем.
Одним из преимуществ ИБП такого типа является широкий диапазон допустимых входных напряжений.
В некоторых линейно-интерактивных моделях есть шунтовая цепь между входом первичной электросети и нагрузкой, такие ИБП называются шунтовыми линейно-интерактивными ИБП (UPS-LIB, Reversible + Bypass). В шунтовом режиме питаемая нагрузка не защищается. При работе с источниками на основе ferro-технологий нужно иметь в виду:
• высокое выходное сопротивление источников может угрожать безопасной работе приборов, препятствуя срабатыванию сетевых предохранителей;
• возможна нестабильная работа (паразитные колебания) при использовании источников для питания приборов с корректорами коэффициента мощности.
Источники бесперебойного питания On-Line типа
Технология On-Line позволяет реализовать самый надежный тип источника бесперебойного питания. С выпрямителя (рисунок 3) напряжение сети поступает на преобразователь постоянного напряжения высокого уровня в низкое ПН1, а далее - на преобразователь постоянного напряжения в переменное выходное напряжение (ПН2). Преобразователь ПН2 - инвертор, питание на который поступает как от аккумуляторов, так и от сети через выпрямитель-преобразователь напряжения ПН1, подключенных параллельно:
• при нормальном входном переменном напряжении инвертор ПН2 питается от выпрямителя;
• при отклонениях в питающей электросети от нормы, входное напряжение для ПН2 снимается с аккумуляторной батареи.
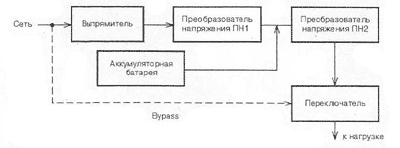
Рис.3. Схем источника бесперебойного питания On-Line типа
В большинстве систем источников бесперебойного питания мощностью до 5 кВА вместо непрерывно подключенного аккумулятора, подключен резервный преобразователь постоянного тока (DC-DC converter), включающийся при сбоях сети и дублирующий шину постоянного тока от низковольтного аккумулятора.
Вывод: даже в случаи незначительных отклонениях параметров входного напряжения от нормы On-Line устройства обеспечивают на выходе номинальное напряжение в области ±1-3%. Присутствие обходной цепи (bypass) позволяет подключать нагрузку прямо к силовой сети. Качество питания и надежность поставки электроэнергии, предоставляемое устройствами с архитектурой такого типа, существенно выше, чем у предыдущих.
Недостатки источников бесперебойного питания On-line типа: невысокий, по сравнению с ранее рассмотренными типами, КПД (85-90%) из-за двойного преобразования (по отношению к Standby и Line-Interactive) и высокая цена. Однако, уровень защиты нагрузки и стабильность выходных параметров ИБП - разумный компромисс между безопасностью, КПД и ценой устройства. Потери в ИБП мощностью в 4000ВА не превышают 380Вт и могут быть несоизмеримыми с той задачей, которую решает подобный источник питания.
Новые модификации источников бесперебойного питания
Сейчас имеется несколько новых модификаций источников бесперебойного питания:
• by-pass;
• triple-conversion;
• ferrups.
Первая модификация (by-pass) как и на рисунке 3 представляет собой дополнительный канал передачи электроэнергии в нагрузку, его наличие позволяет обеспечить высокую надежность устройства. Переключение в режим On-line производится автоматически при отклонении параметров выходной сети от нормы либо же в аварийных условиях работы. Таким образом, этот режим способствует увеличению надежности устройства. Вторая модификация (triple-conversion) содержит корректор коэффициента мощности. В третьей модификации (ferrups) применен феррорезонансный трансформатор, обеспечивающий высокие показатели надежности и широкий диапазон входных напряжений.
Новые подходы в построении источников бесперебойного питания основываются на использовании систем с резервируемым питанием, которые обладают более высокой надежностью выходной сети, так что неисправность одного из элементов не ведет к выходу из строя всей системы. Обычно, это модульные системы, сконструированные или по принципу повышения мощности нагрузки, или для повышения надежности системы, или используя оба принципа совместно. Простейшая система имеет в структуре источника бесперебойного питания вспомогательный модуль, "изолированный в горячем дежурном режиме". Имеется несколько вариантов технических решений таких бесперебойников.
Первый вариант заключается в применении автоматического переключателя (рисунок 4). Входы одного либо более источников питания подключены к единой сети, а с нагрузкой соединяются через автоматический переключатель. Информация о состоянии работы установок, управляющие команды поступают по каналу связи объединяющему ИБП.
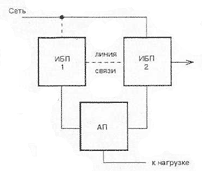
Рис.4. Параллельная схема с использованием автоматического переключателя
Второй вариант содержит "распределитель нагрузки" (рисунок 5), равномерно распределяющий нагрузку между отдельными источниками системы.
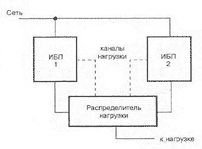
Рис.5. Параллельная схема с использованием автоматического переключателя
Третий вариант осуществления параллельной структуры (рисунок 6) использует принцип двухуровневой системы. В этом способе один из модулей "ведущий" управляет распределением нагрузки между другими "ведомыми" модулями.
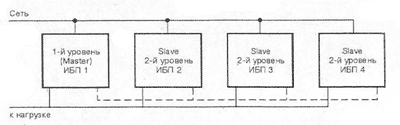
Рис.6. Параллельная схема на основе двухуровневой системы Master-Slave
Четвертый вариант, с резервируемой параллельной архитектурой, выглядит наиболее перспективным. В такой схеме (рисунок 7) резервируются не только модули, но и связи между ними, причем при необходимости любой модуль может выполнять функции ведущего. Лишь для такой схемы характерно наращивание мощности, отсутствие шунтовых цепей, при этом гарантируется непрерывная защита нагрузки при помощи ИБП.
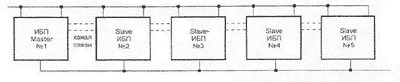
Рис.7. Схема резервируемой параллельной системы
Основные технические характеристики источников бесперебойного питания
Форма питающего напряжения
Важное значение для нагрузки имеет именно эта характеристика источника бесперебойного питания. В режиме работы ИБП от аккумуляторных батарей на нагрузку может поступать выходное переменное напряжение близкое к прямоугольной форме (меандр), из-за сглаживающих свойств фильтров, аппроксимированная синусоида и чистая синусоида. Самая близкая к синусоиде форма выходного напряжения получается применением широтно-импульсной модуляции. Получение синусоиды в качестве питающего напряжения характерно лишь для ИБП On-line и некоторых источников питания Line-Interactive.
Мощность
Полная либо выходная мощность (output power). Обозначается буквой S, единица измерения - VA или Вольт-Амперы. Является геометрической суммой активной и реактивной мощностей. Параметр рассчитывается как произведение действующих (среднеквадратических) значений тока и напряжения. Её значение указывается изготовителем источника питания.
Активная потребляемая нагрузкой мощность. Обозначается буквой P, единица измерения - ватт (Вт). В случаи отсутствия реактивной составляющей в сети, совпадает с полной мощностью. Определяется как произведение полной мощности на косинус угла ?, где ? - угол сдвига фаз векторов линейных напряжения и тока, т.е. P = S • cos(?). Типичное значение cos(?) для персональных компьютеров около 0,6-0,7. Эта величина именуется коэффициентом мощности. Очевидно, что для выбора требуемой мощности для источника бесперебойного питания, надо мощность нагрузки в ваттах разделить на величину cos(?).
Реактивная - обозначается буквой Q и рассчитывается как произведение полной мощности S на синус угла ? (Q = S • sin(?) ). Единица измерения - вольт-ампер реактивный (вар). Характеризует потери в питающих проводах за счет нагружающего их реактивного тока. При cos(?) = 1 потери отсутствуют, вся мощность вырабатываемая источником питания поступает в нагрузку. Достигают этого за счет использования пассивных компенсирующих устройств или же активной коррекцией коэффициента мощности.
Диапазон входного питающего напряжения
Диапазон входного питающего напряжения (input voltage) - определяет пределы допустимых значений напряжения в сети, при которых источник бесперебойного питания еще способен поддерживать напряжение на выходе, не переключаясь на питание от аккумуляторов. Для некоторых моделей этот диапазон зависит от нагрузки. К примеру, при 100% нагрузке диапазон входных напряжений может составлять 15-20% от номинального, при 50% нагрузке - этот диапазон составляет 20-27% от номинального, а при 30% нагрузке - 40% номинального. От этого параметра зависит срок службы аккумуляторов, чем шире диапазон, тем дольше прослужат аккумуляторы при прочих равных условиях.
Частота входного напряжения
Частота входного напряжения (input frequency) - характеризует диапазон отклонения частоты электросети. При нормальных условиях эксплуатации отклонение частоты от номинального значения как правило не превосходит 1 Гц.
Коэффициент искажения формы выходного напряжения
Коэффициент искажения формы выходного напряжения (total harmonic distortion - THD) характеризует отклонение формы выходного напряжения от синусоиды, измеряется в процентах. Маленькие значения коэффициента соответствуют форме выходного напряжения, приближающейся к синусоидальной.
Время переключения режимов
Время переключения режимов (transfer time) характеризует инерционность источника бесперебойного питания, для разных источников составляет приблизительно до 2-15 мс.
Допустимая нагрузка
Допустимая нагрузка (over load) характеризует устойчивость источника бесперебойного питания при перегрузках по мощности, измеряется в процентах по отношению к номинальной мощности. Определяет устойчивость ИБП к нестационарным перегрузкам.
Время автономной работы
Время автономной работы определяется емкостью аккумуляторной батареи и размером нагрузки. Для типовых источников бесперебойного питания небольшой мощности, питающих персональные компьютеры, оно составляет 5-10 мин. Это время рассчитано на то, чтобы пользователь мог закрыть все работающие приложения с сохранением информации и выключить ПК в нормальном режиме.
Крест-фактор
Крест-фактор (crest factor) - отношение пикового значения потребляемого тока к среднедействующему. Величина зависит от формы питающего напряжения.
Срок службы аккумуляторной батареи
Срок службы аккумуляторных батарей составляет 4-5 лет, но реальный сильно зависит от условий эксплуатации: частоты переключений в автономный режим, условий зарядки, окружающей среды.
Наличие холодного старта
Наличие холодного старта - это возможность включения источника бесперебойного питания при отсутствии напряжения в питающей сети. Такая функция полезна, когда необходимо срочно выполнить какие либо действия независимо от наличия напряжения в электросети.
Аккумуляторы ИБП
Общие сведения
Источником, энергия которого используется для питания нагрузки в критических режимах работы, служит аккумуляторная батарея. В источниках бесперебойного питания мощностью до 20 кВт как правило применяются герметичные свинцово-кальциевые аккумуляторы с электролитом суспензионного типа. В аккумуляторах такого типа электролит обездвижен, либо силикагелем либо скекловолокном, что делает их непротекаемыми. Это свойство электролита позволяет эксплуатировать аккумуляторы в любом положении, кроме того, они не нуждается в периодическом пополнении электролита и другом обслуживании.
Электроды произведены из свинцово-кальциевого сплава, обеспечивающего продолжительный срок службы и широкую область применения аккумуляторов, рабочий диапазон температур составляет от минус 20 до плюс 50°С (для некоторых типов аккумуляторов). Аккумуляторы не страдают так называемым "эффектом памяти", могут длительно храниться в заряженном состоянии (до года), при этом ток саморазрядки незначителен.
Конструкция аккумуляторов
Конструкция аккумуляторов традиционна - ударопрочный пластмассовый корпус поделен на секции - "банки". Наборы катодных и анодных пластин разделены прокладками - сепараторами из стекловолокна. Активная часть электролита - серная кислота. Крышка герметично соединена с корпусом, без возможности разобрать аккумулятор. В верхней части крышки размещены клапаны (по одному на каждую секцию), обеспечивающие выпуск газа в случае его избыточного образования в ходе работы, и пластинчатые выводы. Клапаны закрыты дополнительной съемной крышкой.
Хранение аккумуляторов
Продолжительность эксплуатации аккумуляторов составляет приблизительно 5 лет. При ежедневном использовании источника бесперебойного питания, собственные возможности заряда гарантируют эксплуатацию в ходе этого срока. При продолжительном неиспользовании аккумуляторы подвергаются саморазряду. Для аккумуляторов YUASA скорость саморазряда составляет приблизительно 3% в месяц при температуре окружающей среды около 20°С. Если в ходе длительного интервала времени аккумуляторы не заряжаются, то на отрицательных пластинах аккумулятора формируются сульфаты свинца. Это явление известно как "сульфатация". Сульфат свинца действует как изолятор, препятствуя приему заряда аккумулятором. Чем глубже произошла сулъфатация пластины, тем меньший заряд может принять аккумулятор.
Чтобы исключить необратимые последствия при хранении, надо заряд проводить через срок, соответствующий условиям температуры окружающей среды. С целью обеспечения оптимального срока использования, длительно хранящиеся аккумуляторы, должны периодически подзаряжаться.
Способы заряда аккумуляторов ИБП
Зарядка аккумуляторов является главной составляющей ее обслуживания. Срок использования аккумуляторов зависит от эффективности выбранного способа заряда. Имеются следующие способы заряда:
- зарядка при постоянном напряжении;
- зарядка при постоянной силе тока;
- двухступенчатая зарядка при постоянном напряжении.
Предпочтительным способом является зарядка при постоянном напряжении. В этом случае аккумуляторная батарея подключается к источнику энергии, зарядное напряжение которого поддерживается постоянным в ходе всего процесса заряда. В ходе заряда сила тока понижается и становится значительно меньше, чем при заряде способом постоянного тока, и в конце заряда опускается почти до нуля. При этом батарею заряжают до 90-95% ее номинальной емкости.
Выбор источника бесперебойного питания
Спектр типов источников бесперебойного питания, как средств защиты оборудования и компьютерных систем, достаточно широк. Вопрос выбора требуемого источника питания очень непрост. Чтобы решить вопрос выбора того или иного ИБП, надо попробовать проанализировать факторы, влияющие на условия работы источника питания.
Во-первых, надо попытаться оценить значимость питаемой системы. Вполне возможно, что для домашнего или офисного варианта будет достаточно источника бесперебойного питания Off-line либо Line-interactive типа. ИБП On-line типа больше подходит для серверного компьютера и прочих видов нагрузки, имеющих повышенные требования к качеству и надежности электропитания.
Во-вторых, необходимо оценить качество электросети: вероятность и частота отключения напряжения, наличие колебаний напряжения и различных помех.
В-третьих, нужно оценить мощность источника бесперебойного питания. Чтобы ориентировочно представить, какой мощности ИБП требуется, надо определить защищаемую аппаратуру и рассчитать для нее суммарное значение потребляемой мощности. Затем, полученные ватты нужно перевести в ВА, разделив на коэффициент мощности. Для компьютерного оборудования коэффициент мощности равен 0,5-0,6.
Производители не рекомендуют загружать источник бесперебойного питания на величину больше чем 80% от максимальной нагрузки. Надо отметить, что лазерные принтеры не рекомендуется подключать к источнику бесперебойного питания ввиду высокого энергопотребления нагревательного элемента.
Ионистор (или суперконденсатор) - это энергонакопительный конденсатор, заряд в котором накапливается на границе раздела двух сред - электрода и электролита. Энергия в ионисторе содержится в виде статического заряда. Накопление совершается, если к его обкладкам будет приложена разность потенциалов (постоянное напряжение). Концепция создания ионисторов появилась недавно, и в настоящее время они заняли свою нишу применения. Ионисторы успешно могут заменять химические источники тока в качестве резервного (микросхемы памяти) или основного подзаряжаемого (часы, калькуляторы) источника питания.

Ионистор
Если обычный конденсатор представляет собой обкладки из фольги, разделенные сухим сепаратором, то ионистор - это комбинация конденсатора с электрохимической батареей. В нем применяются специальные обкладки и электролит. В качестве обкладок используются материалы одного из трех типов: обкладки большой площади на основе активированного угля, оксиды металлов и проводящие полимеры. Использование высокопористых угольных материалов позволяет достичь плотности емкости порядка 10 Ф/см3 и больше. Ионисторы на базе активированного угля наиболее экономичны в изготовлении. Их еще называют двухслойными или DLC-конденсаторами, потому что заряд сохраняется в двойном слое, образующемся на поверхности обкладки.
Электролит ионисторов может быть водным либо органическим. Ионисторы на основе водного электролита обладают небольшим внутренним сопротивлением, но напряжение заряда для них ограничено 1 В. А ионисторы на основе органических электролитов обладают более высоким внутренним сопротивлением, но обеспечивают напряжение заряда 2...3 В.
Для питания электронных схем нужны более высокие напряжения, чем обеспечивают ионисторы. Для получения нужного напряжения их включают последовательно. 3-4 ионистора обеспечивают напряжение достаточной величины. Величина энергетической емкости конденсаторов измеряется в пикофарадах, нанофарадах и микрофарадах, в то время как емкость ионисторов (суперконденсаторов) на самом деле огромна и измеряется в фарадах (Ф). В ионисторах достижима энергетическая плотность от 1 до 10 Вт/кг. Она больше, чем у типичных конденсаторов, но меньше, чем у аккумуляторов. Относительно низкое внутреннее сопротивление ионисторов обеспечивает хорошую проводимость.
Ионистор может запасать энергию, примерно равную 1/10 энергии никель-металлгидридного аккумулятора. В то время как аккумулятор выдает относительно постоянное рабочее напряжение, напряжение на ионисторе понижается линейно от рабочего значения до нуля и ему не присущи такие плоские зоны характеристики разряда, как у аккумуляторов. По этой причине ионистор не способен удерживать полный заряд. Степень его заряда определяется в процентах и зависит в первую очередь от того приложения, в котором он применяется.
Например, если 6-вольтовая батарея допускает разряд до 4,5 В, пока оборудование не выключится, ионистор достигает этого порога в течение первой четверти времени разряда. Оставшаяся в нем запасенная энергия оказывается бесполезной. Для повышения степени использования запасенной в ионисторе энергии можно использовать DC/DC преобразователи, однако такой путь недостаточно результативен и к тому же ведет к удорожанию системы на 10-15%.
Чаще всего ионисторы используют для питания микросхем памяти, и иногда ими подменяют электрохимические батареи. Кроме того, их используют в цепях фильтрации и сглаживающих фильтрах. Ионисторы могут работать и в буфере с батареями в целях защиты их от резких скачков тока нагрузки: при низком токе нагрузки батарея подзаряжает суперконденсатор, и если ток резко возрастет, суперконденсатор отдаст запасенную энергию, чем уменьшит нагрузку на батарею. При таком варианте использования его размещают либо непосредственно возле аккумуляторной батареи, либо внутри ее корпуса.
Преимущества ионисторов:
• большой срок службы;
• малое внутреннее сопротивление - обеспечивает сглаживание импульсов (бросков) тока нагрузки, если ионистор включен параллельно аккумуляторной батарее;
• быстрый заряд - в течение нескольких секунд из-за низкого внутреннего сопротивления;
• работа ионистора при любом напряжении, не превосходящем номинального;
• неограниченное число циклов заряд/разряд;
• отсутствие необходимости контроля за режимом зарядки;
• использование простых методов заряда;
• широкий диапазон рабочих температур: -25...+70 °С;
• относительная дешевизна ионисторов.
Недостатки ионисторов:
•не обеспечивают достаточного накопления энергии;
• маленькая энергетическая плотность;
• низкое напряжение на некоторых типах ионисторов;
• для получения требуемого напряжения необходимо последовательное подключение не менее трех ионисторов;
• высокий саморазряд.
Применение ионисторов:
• телевизоры, СВЧ-печи: резервное питание таймера;
•видеокамеры, платы памяти: резервное питание запоминающего устройства во время смены батарей;
•музыкальные центры: питание микросхем памяти установок тюнера;
•телефоны: резервное питание микросхем памяти для хранения номеров абонентов;
•электронные счетчики электрической энергии;
•охранная сигнализация;
•электронные измерительные приборы и т.п.
Проблема изготовления энергоемких аккумуляторов приобретает особое значение в связи с быстрым развитием транспорта. Автомобили пожирают запасы дорогостоящего горючего и загрязняют атмосферу. В 1898 году француз Ж. Шасслу-Лоба достиг на электромобиле скорости 63 км/ч. А через год гонщик К. Иенатци установил мировой рекорд скорости на суше - почти 160 км/ч на машине, оборудованной аккумуляторной батареей массой около 2 т. Между тем в Чикаго в начале XX века количество электромобилей приблизительно вдвое превосходило количество машин с бензиновыми двигателями. В чем же дело? Почему до сих пор автомобилестроители не перешли на экологически безопасную электроэнергию? Увы, главная проблема как раз и заключается в аккумуляторах. Ведь современный свинцово-кислотный аккумулятор весом пять с половиной килограммов, может накопить и удержать в себе столько энергии, сколько ее заключено... в рюмке бензина! Сорок литров бензина - емкость бака обычной легковой машины - по заключенной в них энергии равноценны энергии аккумуляторных батарей весом четыре с половиной тонны. А время заряда-заправки? Сорок литров бензина вы зальете за пять, ну, за десять минут. Перезарядка же аккумуляторов тянется часами.
Электромобили не вписываются и в общий темп существующего дорожного движения. Такие машины медленно разгоняются и трудно берут подъемы. Их максимальная скорость и дальность пробега между перезарядками аккумулятора невелики. Так что пока эта техника, на радость нефтегазовым королям, не конкурентоспособна.
Однако технологии химических источников питания не стоят на месте. Существуют серно-натриевые и хлорно-литиевые аккумуляторы с удельной емкостью раз в десять, а то и в двенадцать большей, чем у свинцово-кислотных аккумуляторов. Натрий - металл, обладающий высокими энергетическими свойствами. В рабочем состоянии и натрий и сера нуждаются в подогреве, чтобы перейти в расплавленное состояние. Их разделяет контейнер из пористой керамики, изготовленной на основе алюминия. Главное свойство контейнера - его способность пропускать только ионы натрия. Для ионов серы и для атомов обоих химических элементов керамическая мембрана - непреодолимый барьер. Следовательно, керамика играет роль как бы твердого электролита. Но хотя натрий и сера плавятся при температуре 97-119 °С, для успешного протекания электрохимической реакции их нужно нагреть до 300 °С, не ниже. Правда, серно-натриевый аккумулятор требует постороннего источника тепла только для начала работы. Потом требуемая температура поддерживается за счет тепла, выделяемого в ходе химической реакции.
Серно-натриевый элемент недорог. Применяемые в нем материалы не дефицитны. Во время работы из него не выделяются газы, значит, его можно герметизировать. А если прибавить к этому еще и простоту заряда, то может показаться, что решение проблемы у нас в кармане. Но попытаемся перечислить и недостатки. Сера и натрий - огнеопасны. А перед работой аккумулятор необходимо подогревать. Едкие вещества легко разъедают герметическую оболочку. И натрий так активно соединяется с водой, что эта реакция близка взрыву. Да и расплавленная сера при контакте с воздухом образует ядовитый сернистый газ. Так что, несмотря на герметичность, такой аккумулятор требует большой осторожности при использовании.
Похож и хлорно-литиевый аккумулятор, удельная энергоемкость которого еще выше. Но у него серьезным недостатком является ядовитость хлора. А ну как прорвется он где-нибудь!.. Конечно, бензин тоже не такое уж безопасное вещество, особенно если поблизости есть открытый огонь. Но к особенностям бензина все привыкли. А вот к характеру натрия и лития, хлора и серы мы относимся пока настороженно.
Тем не менее созданы очень интересные электрические консервы. Вот, например, литиево-никельгалоидный аккумулятор. В нем работает уже знакомый нам металл литий и неядовитое неорганическое фтористое соединение никеля. Этот аккумулятор не требует подогрева, не выделяет газ, что позволяет сделать его совершенно герметичным. Энергоемкость его - на уровне супераккумуляторов, описанных выше, а процесс зарядки длится лишь несколько минут. Только вот мощность его невелика.
Литий-серные аккумуляторы Разрабатываются также дешевые аккумуляторы системы Li/S с рабочим напряжением 2,1В. Электроды этих аккумуляторов покрыты полимерной пленкой, причем катод находится практически в жидком состоянии. Интерес к этой электрохимической системе определяется рядом очевидных достоинств:
- теоретическая удельная энергия ее составляет 2600 Вт•ч/кг что в 4 раза выше чем у литий полимерных аккумуляторов;
- присущий природе системы внутренний механизм безопасности позволяет отказаться от компонентов защиты;
- допустимая высокая скорость разряда (до 10 С);
- низкая цена материалов, при которой стоимость аккумулятора соизмерима со ценой никель-кадмиевого;
- широкий диапазон рабочих температур (от -40 °С);
- экологическая безопасность.
Представляют интерес также аккумуляторы для электромобилей системы Li/FeS2 с расплавленным электролитом, которые работают при температуре 400-500 °С. Интерес к этой системе обусловлен тем, что теоретическая удельная энергия ее составляет 1270 Вт•ч/кг, а катодный материал недорогой и нетоксичен. Уже появились сообщения о разработке аккумуляторов системы Li/FeS2 с полимерным электролитом, диапазон рабочих температур которого лежит в диапазоне 90-130 °С. Ведутся дальнейшие работы по снижению рабочей температуры.
Гибридные энергетические системы Представляют интерес разработки по созданию гибридных энергетических систем, в которых объединены высокоемкие, но маломощные источники тока (например, воздушно-цинковые элементы) и источники тока, способные к разряду большими токами, вроде литий-ионных батарей или ионисторов. В этом случае при переменной нагрузке удается извлечь энергию большую, чем суммарная энергия обоих источников тока, и при более высоком напряжении.
Топливные элементы Интересное и перспективное направление - разработка топливных элементов. Правда, отдельные исследователи считают, что эти системы относятся скорее к электрическим машинам. Они их так и называют: электрохимические генераторы (ЭХГ). В топливных элементах свободная энергия электрохимической реакции переходит прямо в электрическую энергию. Вот, например, как работает водородно-кислородный топливный элемент: газ водород поступает из баллона-термоса, где хранится в сжиженном состоянии, к отрицательному электроду-катализатору. Здесь газ ионизуется. Точно так же к положительному электроду поступает кислород. Ионы водорода проходят сквозь ионообменную мембрану, соединяются с ионами кислорода. Образовавшаяся в результате реакции вода - единственный выхлоп такого элемента-генератора. Заманчивая перспектива, не так ли? Тем более что в качестве топлива может использоваться не только сжиженный водород, но и другие вещества.
Интенсивно ведутся исследования по созданию топливных элементов, портативных и мощных, на различном топливе: метаноле, боргидриде, бутане, даже обычном дизельном. Пока их стоимость чересчур велика, но прогноз на возможность снижения цены вполне оптимистичен.
Сразу несколько компаний, среди которых NEC Corp., Manhatten Scientifics Inc., MTI Microfuel Cells Inc., Toshiba Corp., объявили о начале выпуска в 2005 г. топливных элементов для портативной электротехники, в первую очередь для сотовых телефонов и ноутбуков.
Пока характеристики топливных элементов находятся на уровне характеристик литий ионных аккумуляторов, но теоретически достижимые характеристики в 5 раз выше. Специалисты предсказывают существенный рост производства таких источников тока в ближайшие 5 лет. При этом, так как портативные топливные элементы обычно имеют заменяемые картриджи, возникнет потребность в их массовом выпуске.
Эксплуатация первичных источников тока
Выбор первичных источников тока целесообразен лишь при незначительном потреблении энергии устройством, для которого они предназначены. Такой выбор подкрепляется ценой, которая в разы меньше стоимости аккумуляторов и необходимых зарядных устройств, также простатой эксплуатации и иногда большим сроком хранения.
Надо заметить, что паспортное номинальное напряжение марганцево-цинковых элементов несколько больше номинального напряжения щелочных аккумуляторов (Ni-Cd, Ni-MH). Но это всего лишь терминологическая путаница. Начальное напряжение элементов под нагрузкой быстро уменьшается, и большая часть разряда осуществляется при напряжении в диапазоне 1,2-1,1 В, в то время как номинальное напряжение аккумулятора - это, по определению, его напряжение в средней части разрядной кривой. Поэтому большая часть разряда аккумулятора при такой же нагрузке осуществляется при более высоком напряжении (примерно на 50-100 мВ).
Эксплуатация аккумуляторов
Главные проблемы при организации эксплуатации вторичных химических источников тока (аккумуляторов), решение которых определяет эффективность их функционирования и длительный срок службы:
- обеспечение эффективного заряда
- обеспечение ресурсосберегающих условий работы и хранения
- выполнение необходимых профилактических действий.
Способы заряда аккумуляторов
Способы заряда аккумуляторов имеют особенности, определяемые природой протекающих в них процессов.
На рисунке 1 изображены основные стратегии заряда (изменения тока в процессе заряда), которые применяются при заряде аккумуляторов разных систем, и характер изменения напряжения источника тока.
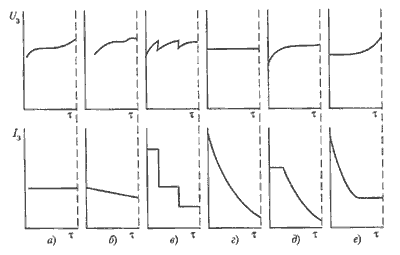
Рис.1. Методы заряда аккумуляторов:
а - при постоянном токе; б - при снижающемся токе; в - при ступенчатом изменении тока; г - при постоянном напряжении; д, е - комбинированные способы
Стремление к ускорению процесса заряда естественно и при использовании аккумуляторов для бытовой аппаратуры, и тем более для аппаратуры, работающей в производстве. При эксплуатации выбранного источника тока, нужно прежде всего учитывать, какие возможности обеспечены технологией производства аккумулятора, используемой данной компанией, и оговорены в документации. Гарантированный срок службы может быть обеспечен только при соблюдении всех рекомендаций и ограничений.
Зарядка щелочных аккумуляторов и батарей
Зарядные характеристики никель-кадмиевых (Ni-Cd) аккумуляторов при заряде в стандартном режиме (током 0,1 С в течение 14-16 ч) приведены в cоответствующей статье, особенности заряда никель-металлгидридных (Ni-MH) - в статье про Ni-MH аккумуляторы. Заряд производится в интервале температур от 0 до +50 °С, наиболее эффективно процесс идет в более узком интервале температур: от +10 до +40 °С.
При низкой температуре заряд проходит при более высоком напряжении конца заряда, чем обычно (до 1,7 В). При температуре ниже 0 °С аккумулятор заряжают очень маленькими токами, порядка 0,02 С. Токи большей величины могут быть применены только для аккумуляторов серий, разработанных для быстрого заряда. В этом случае аккумуляторы на первых минутах разогреваются, и условия заряда улучшаются.
Ускорение процесса заряда щелочных аккумуляторов постоянным током (гальваностатический режим заряда) стало возможным как в результате модернизаций самих аккумуляторов, приведших к созданию аккумуляторов с тонкими электродами и плотной рулонной сборкой пакета электродов, так и благодаря исследованию возможности контроля процесса при больших его скоростях и успехам электронной техники, позволившим осуществить этот контроль.
Для значительной части современных щелочных аккумуляторов допускается ускоренный заряд: током 0,3 С с контролем по времени (но не более 4 ч). Потребность уменьшения степени перезаряда при таком режиме заряда связана с более быстрым повышением давления в аккумуляторе в конце процесса, так как скорость выделения кислорода повышается, а скорость переноса его к отрицательному электроду и поглощения остается практически неизменной. Разрядная емкость аккумулятора при указанных плотностях тока заряда не понижается. Для аккумуляторов с пакетом электродов в виде рулона допускают также и быстрый заряд в течение 1 ч, иногда меньше, но при обязательном специфическом контроле процесса. Заряд в ускоренном режиме допускается в интервале температур от +5 до +50 °С. Быстрый заряд в течение 1 ч эффективен при температуре от +10 до +40 °С.
Нужно отметить, что многие современные типы щелочных аккумуляторов выдерживают достаточно длительный перезаряд стандартными токами заряда (0,1С) без повреждения, поэтому их можно заряжать и при наличии остаточной емкости. Но систематические перезаряды существенно сокращают срок их службы. Поэтому, если нет уверенности в полном исчерпании емкости аккумулятора, перед зарядом иногда целесообразно разрядить его до напряжения 1 В/ак. Процесс переподготовки при этом удлиняется. Однако доразряд перед каждым зарядом не только мало удобен в эксплуатации, но и вреден, поскольку приводит к сокращению срока службы.
Иногда аккумуляторные батареи снабжаются индикатором, который должен обеспечивать пользователю информацию о состоянии ее заряженности. Информация эта может быть получена при оценке уровня напряжения или при вычислении баланса зарядной и разрядной емкости. В обоих случаях точность невелика, и индикатор скорее создает иллюзию знания состояния заряженности, чем отражает истинную ситуацию. Повысить точность индикации состояния не представляется возможным из-за ограничений, диктуемых самим аккумулятором. Оценка состояния заряженности батареи по ее напряжению не может быть выполнена точно, так как у большинства современных источников тока напряжение мало меняется вплоть до исчерпания 80-90% емкости. Оно зависит от температурных условий и в процессе циклирования аккумулятора меняется. Если же контролируется баланс зарядной и разрядной емкостей, то нужно помнить, что оценить их при интегрировании тока нетрудно, но коэффициент отдачи по емкости меняется как в зависимости от тока нагрузки и температурных условий, так и от наработки аккумуляторной батареи.
Возможен другой подход к проблеме переподготовки: при неизвестной остаточной емкости перезаряжаемого источника тока сообщить ему при заряде ровно столько энергии, сколько нужно для достижения состояния полной заряженности аккумулятора при любой степени его деградации. Главная проблема, которая возникает при таком подходе, состоит в поиске параметра, измерения которого дали бы возможность с достаточной точностью оценить это состояние.
В процессе заряда герметичных щелочных аккумуляторов изменяется несколько параметров: напряжение, температура, внутреннее давление. Характер этих изменений в процессе заряда герметичного никель-кадмиевого аккумулятора покачан на рис. 2. Эти параметры обеспечивают разную чувствительность и имеют разные ограничения при использовании. Характер изменения указанных параметров у никель-металлгидридного аккумулятора аналогичен, но Ni-MH аккумуляторы более чувствительны к перегреву при перезаряде. (см. статью)
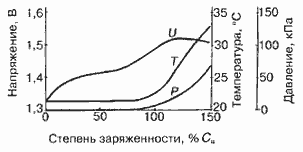
Рис.2. Изменение характеристик герметичного никель-кадмиевого аккумулятора при заряде
О режиме компенсационного подзаряда щелочных аккумуляторов
После быстрого заряда аккумулятор обычно рекомендуется перевести в режим заряда током 0,03-0,05 С, который позволит безопасно дозарядить его. Такой же режим используется и для постоянного подзаряда с целью компенсации саморазряда, если аккумулятор не используется сразу для разряда на нагрузку. Но не следует долго оставлять аккумулятор в этом режиме, так как это способствует сокращению его срока службы.
Для работы в режиме непрерывного подзаряда даже при повышенной температуре многие компании разработали специальные серии высокотемпературных никель-кадмиевых аккумуляторов, которые несколько лет способны работать в буферном режиме с основным источником питания.
Также рекомендуется другой компенсационный заряд: импульсным режимом токами в диапазоне 0,1-1 С. Ток 0,1 С должен протекать 1 ч в сутки, ток 1 С - в течение 5-6 мин каждые сутки. Такой режим много раз был проверен в лабораторных условиях и является наиболее дешевым способом компенсации саморазряда. Он кажется наиболее целесообразным с точки зрения уменьшения влияния чрезмерного насыщения кислородом, миграции кадмия и роста дендритов. Но это несколько более трудно осуществимый режим эксплуатации.
Заряд свинцово-кислотных аккумуляторных батарей
Наиболее часто применяемые герметизированные свинцово-кислотные источники тока - это батареи 6 и 12 В моноблочной конструкции. Но для анализа режимов и условий их эксплуатации следует рассматривать условия работы и параметры отдельных аккумуляторов, так как именно они и определяют все ограничения, которые следует учитывать при работе батарей.
Как сказано в другой статье, для заряда герметизированных свинцово-кислотных аккумуляторов рекомендуется потенциостатический режим при ограничении первоначального тока (комбинированный режим заряда).
Проблема ускорения заряда без интенсивного газовыделения для этих аккумуляторов решалась не так как для щелочных. Успехи технологии привели к возможности использовать на первой ступени комбинированного заряда достаточно большие начальные токи (до 0,3 С). К моменту достижения критического для заряда напряжения аккумулятор получает около 80-90 % Сн. На второй ступени (при постоянном напряжении) аккумулятору сообщается еще 20-30 % Сн. Продолжительность второй ступени больше, чем первой, так как при потенциостатическом режиме ток заряда постепенно понижается в зависимости от степени заряженности аккумулятора. Режим заряда соответствует схеме, показанной на рис. 1, д.
При указанных параметрах тока и напряжения ускоренный заряд герметизированных свинцово-кислотных батарей стал возможен за несколько часов (вместо 20 ч). Сильного разогрева батарей при этом не происходит. Заряд прекращают либо по истечении заданного времени, либо при снижении тока заряда до величины порядка 0,02 С. Дальнейший заряд не только не повышает его эффективности, но и вреден из-за медленного, но постоянного протекания побочных процессов газовыделения.
Следует заметить, что все небольшие отклонения от рекомендованного производителем режима заряда (величина начального тока, точность поддержания постоянного напряжения, величина параметра, используемого для оценки конца процесса) сказываются не столько на эффективности единичного заряда, сколько на ресурсе источника тока. Производители же зарядного оборудования интересуются главным образом возможностью зарядить батарею до нужного уровня без ее повреждения и редко принимают во внимание влияние реализованного режима на скорость деградации батарей в процессе продолжительной эксплуатации. Поэтому покупатель зарядного оборудования должен сам внимательно отнестись к информации, представленной производителем аккумулятора.
При использовании герметизированных свинцово-кислотных батарей в буферном режиме следует также точно соблюдать рекомендации производителя относительно постоянного напряжения источника питания, при котором они должны работать и подзаряжаться. При превышении этого параметра в батарее чаще срабатывает аварийный клапан и со временем происходит высыхание сепаратора, отчего внутреннее сопротивление аккумуляторов возрастает и емкость снижается.
Заряд литий-ионных аккумуляторов
Режим заряда литий-ионных аккумуляторов подобен тому, что используется для герметизированных свиниово-кислотных источников тока (см. рис. 1, д) но параметры комбинированного заряда, естественно, отличаются (см. соответствующую статью).
При заряде разряженного аккумулятора до предельного напряжения обычно сообщается 60-70 % номинальной емкости. Полный заряд достигается при постоянном напряжении и понижающемся токе. Он заканчивается, когда ток снижается до 0,03 С.
Компенсационный заряд для литий-ионных аккумуляторов не применяется. Вместо этого для компенсации небольшого саморазряда может быть применен порционный подзаряд 1 раз в 20-30 дней, когда напряжение понизится до 4,05 В.
Конечное разрядное напряжение, которое допускается для литий-ионных аккумуляторов, - 2,5В. Производители рекомендуют использовать подзаряд, чтобы напряжение аккумуляторов всегда было в интервале 2,5-4,2 В. Следует помнить, что не всякое зарядное устройство может обеспечить включение батареи на заряд, если напряжение батареи станет ниже 2,5 В.
Нестационарные режимы заряда
Для заряда источников тока разных электрохимических систем с водным электролитом применяются и разнообразные стратегии нестационарного заряда, которые отличаются от регламентированных производителями, но во многих исследованных случаях обеспечивают улучшение эксплуатационных характеристик источников тока. Интерес к таким методам заряда возник давно, когда было показано, что при осаждении и кристаллизации металлов для создания мелкозернистого осадка, при котором обеспечивается большая рабочая поверхность электродов, могут быть использованы токи промышленной частоты.
К нестационарным способам могут быть отнесены различные методы импульсного (пульсирующего) заряда. Влияние пульсирующего тока сказывается не только на формировании структуры осадка, но более всего на ходе побочных процессов при заряде химических источников тока с водным электролитом, т. е. оно особенно заметно в конце заряда и при перезаряде. Паузы между импульсами тока обеспечивают снижение выделения кислорода на положительном электроде (за счет снижения поверхностного потенциала и выравнивания потенциала в его поровом пространстве) и улучшают условия его поглощения на отрицательном электроде. Это позволяет существенно увеличить средний ток заряда и сократить время заряда. Такой режим заряда способствует понижению скорости деградационных процессов в герметичном аккумуляторе.
Амплитуда, частота следования и скважность импульсов могут быть либо неизменными на протяжении всего зарядного процесса, либо изменяться в зависимости от степени заряженности аккумулятора. Учитывая особенности протекания электрохимических процессов в поровом пространстве электрода, характер и скорость изменения концентрации электролита вблизи его поверхности, повышение эффективности заряда при пульсирующем токе обеспечивают за счет снижения к концу заряда (при повышении зарядного напряжения) амплитуды импульсов или увеличения длительности пауз.
Наложение разрядного импульса в паузе между зарядными, приводит к режиму асимметричного тока. В целом, параметров, которые при режиме заряда асимметричным током могут регулироваться независимо, много: амплитуда и длительность импульсов обеих полярностей, форма импульсов, частота их следования, продолжительность паузы между ними. Наилучшие параметры процесса заряда реальных аккумуляторов могут быть найдены только на основании детального изучения влияния всех параметров нестационарного режима на пористые электроды и аккумулятор как систему.
Обширные исследования продемонстрировали, что при нестационарных режимах заряда амплитуда зарядных импульсов определяет возможность эффективного заряжения активной массы положительного электрода, частота определяет проработку в глубь его пористой структуры, амплитудные и временные характеристики разрядных импульсов действуют на глубину его деполяризации и возможность вести основной токообразующий процесс без побочного практически до конца заряда.
Рассматриваются два этапа заряда. В начале заряда степень окисления изменяется по глубине и кислород еще не выделяется. Разрядный импульс обеспечивает более равномерное распределение процесса заряда по всей толщине электрода. На втором этапе на поверхности электрода происходит интенсивное образование кислорода, а в глубине его продолжается заряд активной массы. В этот период разрядный импульс тормозит выделение кислорода и тем самым содействует более равномерному окислению активной массы по глубине электрода.
Исследование особенностей фазовых превращений в цикле заряда-разряда дает основание предположить, что после разрядного импульса целесообразно иметь некоторую паузу. Исследования показали также, что важна не только величина зарядного импульса, но и скорость его нарастания: при больших скоростях образование кислорода происходит позже. Поэтому прямоугольные импульсы могут быть более результативными, чем другие.
Однако, проблема рациональности применения отрицательных импульсов в зарядном процессе не раз обсуждалась зарубежными специалистами. Дискуссия началась еще в 1960-х годах после активной пропаганды этого режима для быстрого заряда никель-кадмиевых батарей владельцем соответствующего патента США. Компания GENERAL ELECTRIC долгое время изучала этот режим без видимых положительных эффектов и отказалась от его внедрения. Тем не менее заряд с импульсами разрядного тока предлагается рядом производителей зарядного оборудования.
Например, для никель-кадмиевого аккумулятора с металлокерамическими электродами были предложены два варианта ускоренного режима заряда знакопеременным током:
1. Режим наименьшего времени заряда (10-20 мин): амплитуда зарядного импульса Iзар.имп.=(5-8)С; соотношение амплитуд Iраз.имп./ Iзар.имп.= 5-6; длительность зарядного импульса - 0,2 с, разрядного - 0,01 с.
2. Режим наименьшего газовыделения (25-35 мин): Iзар.имп.=(2,8-3,5)С, все прочие параметры и соотношения - те же.
Необходимо отметить, что указанные параметры режима заряда не следует рассматривать как оптимальные для всех щелочных аккумуляторов, поскольку эффективный заряд аккумуляторов определяется не только их электрохимической природой, но и особенностями их конструкции, а также достигнутыми в процессе производства параметрами структуры электродов.
Отметим, что за последнее десятилетие герметичные щелочные аккумуляторы значительно изменились. Тонкие электроды и рулонная сборка пакета электродов аккумуляторов позволяют применять для большей их части быстрый заряд постоянным током 1С, а иногда и более большим, а также импульсным с частотной или амплитудной модуляцией.
Хранение химических источников тока
При хранении химических источников тока необходимо прежде всего четко представлять, в каком состоянии их следует хранить, какой температурный режим соблюдать. Более низкая температура хранения батарей обеспечивает торможение всех химических процессов, в том числе и деградационных, и способствует повышению срока их годности.
Необходимость хранения источников тока различных электрохимических систем в разном состоянии заряженности определяется характером проходящих в них процессов. Важно замедлить те процессы, которые приводят к труднообратимым изменениям активных масс, к росту внутреннего сопротивления аккумуляторов и снижению разрядной емкости.
Хранение первичных источников тока
Для первичных источников тока сроки их хранения и температура хранения представлены в таблице. Хранить элементы рекомендуется при температуре возможно более низкой, при которой самопроизвольное протекание процессов тормозится.
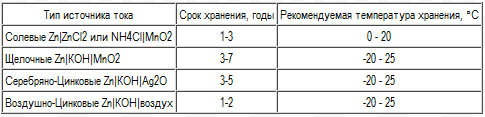
Хранение аккумуляторов
Ниже представлены данные об условиях хранения аккумуляторов разных электрохимических систем.
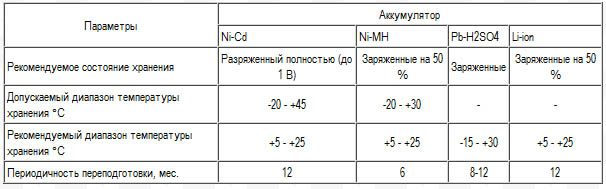
При хранении разряженных Ni-Cd аккумуляторов в них происходят изменения, определяемые перераспределением электролита внутри аккумулятора и дегидратацией оксида кадмия. В результате этих процессов внутреннее сопротивление аккумуляторов увеличивается, и при первых циклах после возобновления работы они не могут эффективно зарядиться и отдать регламентированную емкость. Этот эффект может быть устранен без понижения уровня работоспособности аккумуляторов, соответствующего их наработке к моменту прекращения работы. Для этого после одного года хранения в разряженном состоянии до начала нового периода эксплуатации в документации рекомендуется сделать не менее 3-5 циклов заряда-разряда в стандартном режиме. При первом восстановительном заряде напряжение аккумуляторов может быть существенно выше стандартного, но в процессе заряда оно постепенно падает, а затем при перезаряде начинает расти, как и обычно. Характер изменения зарядного напряжения на всех восстановительных циклах различен: с каждым циклом он все больше напоминает типичный для свежих аккумуляторов. Разрядная емкость от цикла к циклу повышается и после 3-5 цикла стабилизируется.
При более продолжительных сроках хранения для восстановления работоспособного состояния аккумуляторов может быть рекомендована более низкая скорость первого заряда, в некоторых случаях ток первого заряда целесообразно понизить до 0,05 С.
При хранении полузаряженных Ni-MH аккумуляторов у них в результате саморазряда уменьшается остаточная емкость. Напряжение при этом может упасть до нуля. Восстановить полностью начальные характеристики после такого глубокого разряда, как правило, не получается. Поэтому не реже чем раз в 6 месяцев рекомендуется их разрядить и заново зарядить на 50 % для дальнейшего хранения. При необходимости ввести их в эксплуатацию следует дать им 3-5 циклов заряда-разряда в нормальном режиме.
Хранение герметизированных свинцово-кислотных аккумуляторных батарей во избежание сульфатации пластин происходит в заряженном состоянии. Если батареи не используются продолжительное время, рекомендуется их периодический (1 раз в 8 месяцев) подзаряд в течение 6-12 ч при постоянном напряжении 2,45 В/ак. Если свинцово-кислотные аккумуляторы хранились при температуре ниже -20 °С, то подзаряд должен проводиться 1 раз в год в течение 48 ч при постоянном напряжении 2,275 В. Хранение при температуре выше 30 °С не рекомендуется. После хранения при температуре из рекомендованного интервала подзарядка может быть выполнена в течение 6-12 ч постоянным током 0,05 С.
Литий-ионные аккумуляторы рекомендуют хранить при комнатной температуре и степени заряженности порядка 30-50 % и 1 раз в год выполнять подзарядку для предотвращения их переразряда. При хранении имеют место необратимые потери емкости, связанные с реакцией электролита с электродами. Это характерно в наибольшей степени для Li-ion аккумуляторов с катодом на основе LiMn2O4. Наибольшие потери емкости при хранении, необратимые и обратимые, имеют место в первые 100 дней, далее скорость изменений уменьшается. Сопротивление Li-ion аккумуляторов при хранении растет, и тем больше, чем выше температура хранения и состояние заряженности.
Профилактические мероприятия при эксплуатации аккумуляторов
Профилактические мероприятия при эксплуатации щелочных герметичных аккумуляторов
Причины, приводящие к необходимости профилактических мероприятий при циклировании герметичных Ni-Cd и Ni-MH аккумуляторов, изложены в других статьях. Рекомендуется 1 раз в месяц выполнять несколько (1-3) полных циклов с разрядом до 1 В на аккумулятор.
Действенность профилактических мероприятий четко прослеживается при массовых обследованиях однотипных щелочных батарей. Например, описаны результаты обследований состояния более чем 2000 герметичных Ni-Cd батарей для портативных систем связи на самолетах, которые показали, что через год использования в режиме циклирования без профилактики 45% батарей требуют замены. При выполнении периодических разрядов до 1 В количество батарей, нуждающихся в замене, уменьшается втрое, а если после разрядов до 1 В осуществлять затем доразряд малым током (в течение 1-2 ч) до 0,5 В, то работоспособность сохраняют 95 % батарей.
Реструктурирование электродных масс, которое имеет место при таких мероприятиях, позволяет восстановить емкость до уровня, близкого к первоначальному, и обеспечить до 1000 циклов при потере емкости не более чем на 20 %.
Похожего эффекта (восстановления мелкокристаллической структуры активных масс) можно достигнуть и периодическим циклированием при заряде асимметричным током. Например, несколько циклов с зарядом знакопеременным током (с одинаковой амплитудой зарядного и разрядного импульса и соотношением этих импульсов 10:1) способны восстановить емкость, которая уменьшилась до критической величины - 0,6Сн.
Профилактические мероприятия при эксплуатации свинцово-кислотных аккумуляторов
При эксплуатации герметизированных свинцово-кислотных аккумуляторов в режиме циклирования ухудшение их параметров происходит в большинстве случаев из-за изменений в активных массах положительного электрода, которые выражаются в разрыхлении и сульфатации. Это приводит к потере контакта между частицами диоксида свинца и уменьшению емкости. Полностью устранить процесс деградации, как и любого старения, нельзя, но следует избегать больших разрядных импульсов, ускоряющих процесс разрыхления массы, и глубоких разрядов аккумуляторов, при которых происходит необратимая сульфатация электродов.
Некоторые производители, которым удалось путем корректировки рецептур снизить вероятность сульфатации электродов при продолжительном хранении при низком напряжении или при частых глубоких разрядах, специально отмечают эти особенности.
Существует возможность восстановления характеристик аккумуляторов, емкость которых уменьшилась до 80 % от начальной, при циклировании с зарядом пульсирующим током (время импульса порядка 100-200 мс, соотношение времени импульса и паузы 1:3). Эта возможность испытывалась на аккумуляторах с решетками из сплавов свинец-сурьма и свинец-кальций-олово. Несмотря на то, что механизмы, вызывающие преждевременную потерю емкости, отличаются, эффект от заряда пульсирующим током наблюдался у обоих типов источников тока. Целесообразно периодически выполнять циклирование в таком режиме для поддержания электродных масс аккумулятора в активном состоянии.
При эксплуатации герметизированных свинцово-кислотных аккумуляторных батарей следует помнить, что в атмосфере помещения, в котором они эксплуатируются, может появиться водорода (из-за сброса излишнего давления при перезаряде батарей). В целях безопасности помещение следует вентилировать, так как для предотвращения взрыва в атмосфере не должно быть содержания водорода в концентрации больше 4%.
Профилактические мероприятия при эксплуатации литий-ионных аккумуляторов
Литий-ионные аккумуляторные батареи не требуют регулярного обслуживания, циклы тренировки слабо влияют на срок службы аккумуляторов. Достоверных сведений о возможности восстановления их параметров после наработки пока не имеется. Следует помнить только, что схемы защиты батареи имеют малое собственное потребление, но тем не менее достаточное, чтобы за несколько месяцев напряжение батареи могло уменьшиться до 2,5 В. В этом случае многие зарядные устройства не дадут возможности зарядить потерявшую емкость батарею. Если батарея не используется в режиме циклирования, нужно периодически подзаряжать ее на 30-50 %.
В течении эксплуатации химических источников тока часто возникает вопрос о возможности определения их технического состояния. Для первичных источников тока - это оценка их сохранности и способности обеспечить определенный рабочий диапазон напряжения. Для перезаряжаемых (вторичных) источников тока имеют смысл два вопроса: возможность определить в любой момент величину остаточной емкости и прогноз дальнейшей работоспособности. При анализе этих задач мы сталкиваемся с тремя проблемами:
- существование параметров источников тока, которые позволили бы с требуемой точностью обеспечить оценку их состояния;
- разброс значений этих параметров у источников тока одного типа;
- существование простой аппаратуры, позволяющей произвести тестирование источника тока, и методик определения его состояния.
Оценочные параметры источников тока
При диагностике технического состояния любого объекта методы неразрушающего контроля всегда предпочтительнее. В случае источника тока это методы, позволяющие оценить его состояние без потери энергии или при очень малой ее потере.
Как для определения остаточной емкости источника тока, необходимость в которой характерна и для первичных источников тока, и для перезаряжаемых, так и для прогнозирования последующей работоспособности аккумуляторов, в качестве диагностических параметров могут быть применены одни и те же характеристики источников тока. Это их напряжение при разомкнутой цепи и под нагрузкой, сопротивление, реакция на специфический тестовый электрический сигнал.
Напряжение разомкнутой цепи (НРЦ)
Так как напряжение разомкнутой цепи источников тока разных электрохимических систем практически всегда превышает 1В, а изменения его при потере емкости как правило невелики, для измерений нужно использовать цифровой вольтметр с большим входным сопротивлением, чтобы не нагружать источник тока, и погрешностью не более ±0,1 %. Нужно также исключить воздействие различных факторов, дестабилизирующих измерения: проводить их следует при одинаковой температуре и при стабильном состоянии источника тока.
Попытки использовать измерения напряжения разомкнутой цепи для оценки остаточной емкости источника тока предпринимались чаще всего при диагностировании первичных источников тока. Большого успеха в оценке степени сохранности элементов при измерениях напряжения разомкнутой цепи достигнуть не получилось. Это обусловлено не столько малыми изменениями напряжения разомкнутой цепи элементов при уменьшении их остаточной емкости, сколько тем фактом, что эти изменения соизмеримы с разбросом этого параметра у свежих элементов, особенно от различных производителей. Однако этот параметр благодаря простоте измерений считается приемлемым для грубой оценки сохранности первичных источников тока, даже литиевых, у которых пассивация поверхности анода со временем искажает картину изменений напряжения разомкнутой цепи.
Точно определить состояние заряженности щелочных аккумуляторов с неизвестной предысторией эксплуатации по величине напряжения разомкнутой цепи нельзя. Но такие измерения дают возможность оценить степень сохранности аккумулятора в течение нескольких недель после очередного заряда.
Так, например, в результате исследования саморазряда и скорости уменьшения напряжения разомкнутой цепи аккумуляторов с разной потерей емкости за 28 суток хранения (25, 60 и 28% соответственно) был построен единый график зависимости между величинами напряжения разомкнутой цепи щелочных аккумуляторов и их саморазряда (рисунок 1). Видно, что независимо от скорости саморазряда аккумуляторов все экспериментальные данные могут быть аппроксимированы одной кривой, представляющей почти линейную зависимость между этими величинами.
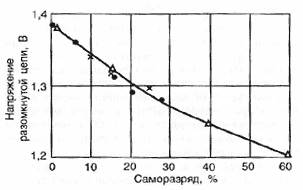
Рис.1. Зависимость напряжения разомкнутой цепи щелочных аккумуляторов от понижения емкости при хранении в течении 1 месяца после заряда
При хранении в течение более длительного времени скорость саморазряда понижается, а характер процессов в аккумуляторе изменяется. Поэтому зависимость между напряжением разомкнутой цепи и остаточной емкостью при потере более 30-40% емкости несколько поменяется. Следует отметить что при длительной эксплуатации из-за различных процессов деструкции, зависимость может существенно изменится.
Уровень разряженности свинцово-кислотных аккумуляторов по величине его напряжения разомкнутой цепи можно определить более точно, потому что концентрация электролита в процессе разряда изменяется линейно и довольно значительно. Изменение напряжения разомкнутой цепи батарей из герметизированных свинцово-кислотных аккумуляторов при изменении степени заряженности показано на рисунке 2.
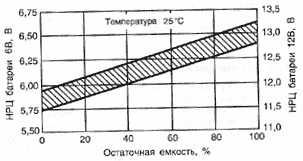
Рис.2. Зависимость напряжения разомкнутой цепи и уровня заряженности герметичных свинцово-кислотных аккумуляторов
Напряжение под нагрузкой (Uраб)
Может показаться, что напряжение источника тока при подключении нагрузки может дать больше информации о его состоянии. Унифицированность замеров для тестирования проще всего обеспечить, если считать рабочим напряжением Uраб такое, которое имеет место для источников тока каждой электрохимической системы при разряде в номинальном режиме.
Но если учесть, что обеспечение стабильности рабочего напряжения является одной из главных проблем при проектировании химических источников тока, отработке его технологии и, наконец, при выборе химического источника тока для определенного технического приложения, то становится очевидным, что этот параметр скорее всего может обеспечить весьма ограниченные возможности для определения степени заряженности источника тока. Так как величина рабочего напряжения определяется не только уровнем заряженности источника тока, но и его индивидуальными особенностями и предысторией использования, в любой момент оценить величину его остаточной емкости по этому параметру нельзя. Более менее четко получается отличить только практически полностью разряженный источник тока от того, который еще сохраняет кое-какую энергию. А учитывая разброс характеристик свежих источников тока, в общем случае трудно надеяться на сколько-нибудь полезную информацию.
Отклик на тестовый сигнал
Повышая нагрузку источника тока, можно больше проявить его индивидуальные особенности. В этом случае в качестве диагностического параметра используется уже отклик источника тока на специальный непродолжительный тестовый сигнал - нагрузку током, обеспечивающим отклик, который можно измерить с достаточной точностью. Учитывая, что внутреннее сопротивление химических источников тока измеряется единицами и десятками миллиом, для того чтобы получить изменение напряжения в несколько милливольт, нужно обеспечить протекание тока порядка 1А и более.
Для того чтобы использовать реакцию на импульс постоянного тока в качестве параметра диагностики, необходимо унифицировать как величину импульса (в величинах относительно емкости источника тока), так и его длительность. Точность оценки напряжения будет зависеть от регламентированных условий измерений и аппаратуры, которая обеспечивает унифицированный тестовый сигнал и измерение отклика с необходимой точностью.
Внутреннее сопротивление
Поскольку, как сказано выше, состояние источника тока может быть лучше всего оценено при непродолжительной его нагрузке током большой величины, появляется желание так организовать измерения, чтобы можно было извлечь как можно больше информации из отклика. Естественна попытка разделить отклик источника тока на протекающий ток в соответствии с долями потерь напряжения на разных составляющих полного сопротивления.
В общем виде напряжение источника тока под нагрузкой описывается формулой:
U = НРЦ - IR = НРЦ - I (R? + Rпол)
где I - ток разряда; R - полное сопротивление химического источника тока. Омическое сопротивление R? определяется сопротивлением токопроводящих деталей электродов, их активных масс и сопротивлением электролита, поляризационное сопротивление Rпол - характером электрохимических процессов. Соотношение R? и Rпол источника тока различно при разной степени его заряженности.
Сопротивление R? отражает все особенности технологического процесса изготовления (количество залитого электролита, распределение его в поровом пространстве электродов и сепаратора, плотность сборки блока электродов, от которой зависит перенос газа от одного электрода к другому). Появляющиеся в процессе эксплуатации дефекты: остаточная деформация корпуса, разбухание электродов, отслоение активной массы, коррозия токоведущих деталей, - сказываются на увеличении именно этого параметра.
Поляризационное сопротивление Rпол отражает динамику электрохимических реакций. Оно повышается при уменьшении степени заряженности. В процессе продолжительной эксплуатации изменения активных масс и состояния поверхности электродов также отражаются на величине Rпол.
Более подробную информацию о поляризационном сопротивлении можно получить при расшифровке отклика источника тока не на импульс постоянного тока, а на протекание переменного тока в определенном диапазоне частот.
Информационные возможности интерпретации результатов измерений сопротивления переменному току связаны с тем, что теория электрических цепей переменного тока опирается на положение, что через химические источники тока ток течет как фарадеевский за счет электрохимических реакций и как ток заряжения двойного электрического слоя.
Сопоставление химических источников тока (ХИТ) разных элек Определение состояния источника тока трохимических систем приводит к выводу, что между ними нет абсолютной заменяемости. Поэтому в ближайшее время в той или иной доле на рынке будут присутствовать все их виды.
Доля первичных химических источников ток (другими словами, одноразовых батареек) и малогабаритных аккумуляторов занимает половину производства (см. рисунок 1)(2003г). Первичные источники тока сохраняют свои позиции в качестве источников питания аппаратуры широкого потребления, прежде всего в устройствах с периодическим использованием в режиме небольшого потребления, при этом доля щелочных марганцево-цинковых элементов больше, чем всех других (см. рисунок 2).
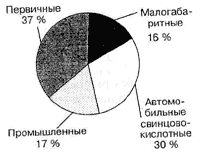
Рис.1. Распределение рынка химических источников ток
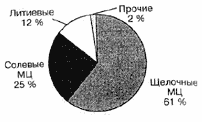
Рис.2. Доли различных электрохимических систем
Характеристики элементов улучшаются на 2-4 % в год. Предполагается появление новых типоразмеров элементов, в первую очередь призматических, что связано с тенденцией уменьшения толщины портативных устройств, в которых они применяются, а также предполагается развитие двух электрохимических систем: первичных Ni-Zn и Li-FeS2 с хорошими характеристиками при высоких токах разряда, разрабатываемых для использования в цифровой технике.
Но доля первичных химических источников ток в секторе цифровой электроники понижается, тем более что емкость вторичных систем (Ni-MH, Li-ion) практически достигла их емкостей.
В производстве щелочных аккумуляторов для электронной техники отмечается увеличение доли никель-металлгидридных аккумуляторов. Исследовательские работы по улучшению характеристик Ni-Cd аккумуляторов во всех ведущих аккумуляторных компаниях мира практически прекращены. И более того, никель-кадмиевые аккумуляторы в ближайшее время попадут под запрет. Тем не менее Ni-Cd аккумуляторы благодаря своим достоинствам (относительно более низкая цена, большой диапазон рабочих температур, отработанность решений) пока что сохраняют свои позиции в некоторых областях. Характеристики Ni-MH аккумуляторов с начала 90-ых годов удалось значительно улучшить: сначала возросла емкость аккумуляторов при низких плотностях тока разряда, далее были увеличены и допустимые разрядные токи. Прогнозируется и дальнейшее повышение этих характеристик.
Вообще же видна общая тенденция вытеснения щелочных аккумуляторов литий-ионным и литий-полимерными аккумуляторами. Она опирается на вполне обоснованные надежды на уменьшения цены литий-ионных аккумуляторов за счет перехода к более дешевым и недефицитным материалам, на улучшения технологии изготовления аккумуляторов и упрощения электронной защиты батарей, на увеличения объемов производства. К 2010 г. прогнозируется увеличение доли продаж литий-ионных источников тока до 70% от общих продаж малогабаритных аккумуляторов. Такой прогноз согласуется с резким ростом требований к характеристикам источников тока, используемых при производстве современной портативной аппаратуры (сотовых телефонов, ноутбуков, видео- и фото- камер).
Литий-ионные и литий-полимерные аккумуляторы используются для питания сотовых телефонов, видео- и цифровых фотокамер, карманных компьютеров и других устройств, где немаловажны высокие удельные характеристики. При этом требование миниатюризации устройств (в первую очередь, по толщине) вызвали рост доли призматических аккумуляторов, в особенности наиболее тонких типоразмеров.
Цена системы электронной защиты литий-ионных аккумуляторных батарей в настоящее время не превышает 30% от цены самих аккумуляторов. Эта система с контролем параметров каждого аккумулятора батареи обеспечивает не только безопасность использования батареи, но и оптимизацию зарядного процесса и возможность получения наибольшей емкости при разряде.
Превосходные удельные энергетические характеристики литий-ионных аккумуляторов, доведение емкости разработанных аккумуляторов до тысяч часов и повышение разрядных токов до 10-20С, расширят круг потенциальных потребителей.
В этой статье сделана попытка вкратце рассказать о компаниях выпускающих батарейки и аккумуляторы и являющихся мировыми лидерами в этой области или лидерами вообще. Конечно же в статье представлены не все компании, а сделан акцент лишь на самые известные.
DURACELL
История Duracell начинается в 20-ых годах 20 века, когда ученый-изобретатель Сэмюэль Рубен и производитель вольфрамовых нитей накаливания Филипп Роджерс Мэлори объединили свои усилия. Поиски нужного для экспериментов оборудования привели Рубена в компанию Мэлори. Однако Мэлори не только предоставил ученому оборудование, но и предложил объединить изобретательный гений Рубена с производственными возможностями своей компании. Благодаря их сотрудничеству и появилась компания PRM, которая позже стала известной как Duracell.
Изобретения Сэмюэля Рубена сделали революцию в области портативных элементов питания. В середине Второй Мировой Войны Рубен изобрел ртутную батарею - компактную и более емкую. Ртутная батарея была более устойчивой к климатическим условиям Северной Африки и южной части Тихого океана, где обычные солевые батареи (используемые в прожекторах и минных датчиках, портативных радиостанциях) не могли эффективно работать. Компания PRM изготовила миллионы ртутных батарей для военных нужд. В то же время Филипп Мэлори принял решение переименовать PRM в Mallory Battery Company.
В 1950-ые годы Сэмюэль Рубен улучшал щелочные батарейки, уменьшая размеры и одновременно увеличивая срок их работы. Приблизительно в то же время компания Eastman Kodak начала производить фотокамеры со встроенной вспышкой, которые требовали большего количества энергии, чем могли давать солевые батарейки.
Таким образом, на массовом рынке создалась потребность в щелочных технологиях. Именно поэтому щелочные батарейки Mallory Battery Company, вышедшие под торговой маркой Duracell, стали пользоваться большим спросом у потребителей.
Сегодня Duracell - ведущий мировой производитель щелочных батарей. Батарейки Duracell реализовываются почти во всех странах мира. Каждая третья из покупаемых в мире щелочных батареек произведена компанией Duracell.
duracell.ru
VARTA
История Varta является бесспорно уникальной, но и во многом типичной для европейской фирмы. Являясь по сути родоначальником производства аккумуляторов на территории Центральной и Восточной Европы, сегодня фирма - это ведущий европейский производитель в этой небольшой, но важной отрасли мировой экономики, а торговая марка Varta стала синонимом качества в отрасли источников тока.
В далеком 1887 году основатель фирмы, позднее получившей название Varta, господин Мюллер был очарован идеей реализовать недавно открытую технологию свинцово-кислотного аккумулятора. Он сумел получить право использование этой технологии на территории Германской, Австро-Венгерской и Российской империй. За тридцать лет до первой мировой войны удалось создать более десяти заводов на территории этих стран. Несколько известных и поныне Центрально-Европейских производителей аккумуляторов были основаны неутомимым Мюллером. Не осталась в стороне и Россия. Так до первой мировой войны самую большую прибыль в фирме давал завод в Санкт-Петербурге. После первой мировой войной Мюллер передал свой бизнес Гюнтеру Квандту. Семья Квандт, известная в России как владельцы концерна BMW, долгие годы являлась главным акционером Varta. Cегодня фирма "Varta Automotive" входит в корпорацию Johnson Controls Inc. (США), ведущего производителя внутреннеей оснастки автомобиля и самого крупного производителя аккумуляторов в мире.
История Varta неразрывно связана с историей автомобиля. В начале 20 века возникла необходимость в небольших аккумуляторных батареях, которые использовались на всевозможных транспортных устройствах, начиная от автомобиля и кончая дирижаблем. Эти изделия носили торговую марку Varta. Varta это аббревиатура (Vertrieb, Aufladung, Reparatur Transportable Akkumulator) - то есть Сбыт, Зарядка, Ремонт Транспортируемых Аккумуляторов. На автомобилях с бензиновым двигателем начала 20 века аккумулятор использовался сначала только для освещения салона, затем для питания свечей и только во время первой мировой войны начал использоваться для старта двигателя.
Каждое новое применение аккумулятора требовало существенного изменения его конструкции. И именно тогда появился своеобразный симбиоз производителей автомобилей Varta. На каждое новое требование к автоэлектрике инженерам Varta удавалось найти новое решение, становившееся эталоном для других производителей.
Вместе с подъемом немецкого автомобилестроения Varta, пережив катаклизмы двух мировых войн, сохранила и преумножила свое европейское лидерство. А в пятидесятых-шестидесятых годах удалось достигнуть такого замечательного качества стартерных аккумуляторов, что было решено присвоить всему концерну имя торговой марки Varta.
Современный аккумулятор похож на своего предшественника начала века не более, чем самодвижущаяся повозка с бензиновым мотором тех лет на современный лимузин. Но неизменным остается формула успеха Varta - быть впереди конкурентов, первыми воплощая последние достижения науки и техники в безупречный технологических процесс.
www.vartaautomotive.ru
ENERGIZER
История компании составляет более 100 лет, и началась в 1886 году, когда W. H. Lawrence сформировал Национальную Углеродную Компанию (National Carbon Company (NCC)) впоследствии ставшую Energizer. В 1896 году Energizer продают самую первую батарейку массового применения, используемую для домашних телефонов. Два года спустя в Нью-Йорке, Российский иммигрант Хьюберт Конрад основал другую компанию - American Electrical Novelty and Manufacturing Company (AENMC) специализирующуюся на батарейках.
В 1905 году AENMC изменила свое название на American Ever Ready и концентрируется на производстве фонарей. Затем в 1914 году AENMC становится частью NCC, образовав компанию занимающуюся как батарейками так и осветительными приборами.
В 1917 году National Carbon Company объединилась с Union Carbide Company и началось расширение деятельности на всю территорию США, Канаду и Мексику. Последующие 32 года Union Carbide Company была известна как поставщик фонарей и батареек всех размеров.
Впоследствии компания дала своим батарейкам и фонарям новый бренд Energizer. Eveready Battery Company/Energizer выпустила первую девятивольтовую батарею в 1956г., первые батарейки для транзисторного радиоприемника и перезаряжаемые никель-кадмиевые аккумуляторы в 1958г., первую стандартную щелочную батарейку в 1959г., первую миниатюрную батарейку-таблетку на основе окиси серебра для слуховых аппаратов и наручных часов в 1960г., начала развитие технологии литий-ионных батарей в 1963г.
В 1959 году Energizer произвела настоящую революцию в индустрии батареек, создав технологию производства щелочных батареек. Это был гигантский шаг к продлению срока жизни батареек в портативных устройствах. Лидерство Energizer в области щелочных батареек сохранялось на протяжении последующих лет благодаря непрекращающимся исследованиям в этой области.
Имея штаб-квартиру в городе Сент-Луис, Energizer относится к числу самых больших в мире производителей батареек и фонарей, и остается преданным идеи удовлетворения всех потребностей потребителя.
MAXELL
История фирмы MAXELL началась в 1961 году после отделения от компании NITTO DENCO Corp., занимавшейся изготовлением аудиокассет и батареек. Первая партия изделий под торговой маркой MAXELL была выпущена в широкую продажу на японский рынок уже в 1963 году. В 1964 году компания сменила свое название на HITACHI MAXELL, Ltd. В дальнейшем фирма успешно развивается и расширяется: в 1969 году открываются отделения в Америке, Азии и Европе. Сеть представительств охватывает Великобританию, Ирландию, Германию, Швецию, Финляндию, Нидерланды, Малайзию, Китай, Гонконг, Сингапур, Вьетнам, Мексику. Строятся заводы в различных городах и странах: в Джорджии, Сан-Диего, Телфорде, Ирландии и т.д.
Фирма быстро реагирует на требования рынка. В соответствии с насущным требованием вычислительной техники в 1976 году разрабатываются и выпускаются в продажу 8-дюймовые дискеты. В 1978 году практически одновременно с появлением первых кассетных видеомагнитофонов формата VHS в Киото начинается производство видеокассет. С широким внедрением персональных компьютеров компания MAXELL энергично включается в производство разнообразных носителей информации для ПК и выходит на лидирующие позиции. В 1984 году был разработан 12-дюймовый оптический диск. С 1993 г. производятся цифровые MD-диски, а в 1995 году уже налажен выпуск записывающих CD-R.
В основе деятельности фирмы лежат три кита. Во-первых, это изготовление цифровых информационных средств. В их число входят сменные материалы для магнитных и оптических накопителей информации (3,5- и 5-дюймовые дискеты, 8-дюймовые мягкие диски и т.д.), устройства памяти, использующие полупроводники (PC-карты, IC-карты, а также бесконтактные карточки памяти и проч.). Во-вторых, компания производит аудио-, видео- цифровые кассеты, в том числе профессиональные DV видеокассеты, 8 мм кассеты для видеокамер, S-VHS/VHS видеокассеты, как простые, так и профессиональные; одно-дюймовые Hi-vision видеокассеты с металлическим покрытием. К этому ряду изделий принадлежат также чистящие кассеты. Третье направление деятельности фирмы - это, конечно, всевозможные батарейки. Среди них, кроме обычных батареек и аккумуляторов, одноразовые и перезаряжаемые: литиевые элементы питания, микробатарейки и никелево-металлические гибридные, а также никелево-кадмиевые элементы.
www.potrebitel.ru
SANYO
Фирма SANYO была создана в 1947 году в г. Осака, когда началось строительство электромонтажного завода.
Когда завод уже был готов к запуску, в апреле 1950 года название нового предприятия окончательно сформировалось в учредительных документах как Sanyo Electric Co., Ltd.
В те времена в Японии компании с "Electric" в названии основывались едва ли не каждый день. Большинство так и не получило известности. Лишь некоторые из них впоследствии сумели стать гигантами электронной промышленности. Моментально став ведущим производителем генераторных фар для велосипедов, всего за несколько лет фирма вошла в число ведущих японских экспортеров, отправляя ежемесячно за границу свыше 100 тысяч комплектов своей продукции. Взлет тем более удивительный на фоне другого факта: вплоть до 1952 года, кроме этих лампочек, Sanyo ничего и не выпускала.
В своей деятельности Sanyo Electric преследует цель - не удивить, а удовлетворить потребителя. Имея, как и прочие гиганты, собственные узкопрофильные производства, научные и опытно-конструкторские подразделения, группа выпускает такую продукцию, которая наилучшим образом приспособлена к тому или иному рынку и потребностям потребителя.
Генераторные фары оказались весьма востребованным товаром. Однако руководивший в 50-е годы Sanyo Electric Иуё Тошио (Iue Toshio) решил, что на одних велосипедных аксессуарах компания далеко не уедет. Он считал, что предприятие, способное применять самые передовые технологии, должно себя обязательно в них проявить. В 1952-м символом этой новизны стал первый в японской индустрии радиоприемник Sanyo SS-52 с пластиковым корпусом.
Однако, гораздо больший успех имели другие новинки, выпуск которых освоила Sanyo в первое свое десятилетие. На американский рынок компания вышла с недорогим, но качественным и надежным ламповым радиоприемником, который экспортировался под маркой RCA. На внутренний рынок - с собственной стиральной машиной (1953), с черно-белыми телевизорами (массовое производство начато в 1955 году), транзисторными радиоприемниками (1956), стереосистемами (1958) и магнитофонами (1960).
Удивителен другой факт: ни в какой из перечисленных областей Sanyo не была первооткрывателем. Потому что и не очень пыталась быть. Всякая новая идея моментально подхватывалась Sanyo, но перед тем, как воплотиться в продукции, она проходила длинный этап доводки. Ведь одно дело - произвести новинку и первым выбросить ее на рынок, и совершенно другое - такое же изделие, но доступное для широкого круга покупателей. Sanyo преуспевала в последнем.
В 1961 году Sanyo уже может называть себя крупнейшим японским экспортером переносных транзисторных приемников. В 1963-м магнитофон Sanyo MR-100 становится бестселлером на мировом рынке. К 1980 году компания доводит изготовление переносных катушечных и кассетных магнитофонов до 15 млн штук в год.
В течение трех лет (1975-1977) экспорт наручных цифровых часов Sanyo по всему миру достигает гигантской цифры: 1,3 млн штук. Это сейчас такие вещи стоят недорого. А в годы своего появления цифровые часы, обладающие невиданными функциями, казались вершиной совершенства и по цене мало отличались от изделий швейцарских часовщиков. Успех часам Sanyo принесла способность подзаряжаться от солнечного света и, конечно же, гуманная цена.
За всю историю Sanyo только единственное изделие могло нести на себе ярлык "Первого в мире" - это полностью транзисторная стереосистема DC-600, созданная в 1963 году.
Каждый раз, покупая батарейки, включая на зарядку аккумулятор мобильника или разговаривая по радиотелефону, мы даже не подозреваем о том, как много сделала компания, чтобы эти изделия стали удобнее, безопаснее и дешевле.
Японская компания Sanyo (Sanyo Electric Co., Ltd.) стала первой в мире компанией, освоившей в 1976 году массовое изготовление литиевых элементов питания (Manganese Dioxid Lithium Battery). Минувшие с этого момента четверть века значительно прибавили популярности литиевым элементам питания - сказались высокие удельная и объемная плотности энергии, широкий диапазон рабочих температур, возможность продолжительного хранения перед началом использования и остальные выдающиеся характеристики этого источника питания, несмотря на их более высокую, в сравнении с другими элементами питания, стоимость.
Сегодня, как и тогда, понятие "качественная литиевая батарейка" тесно связано с именем Sanyo. Литиевые элементы Sanyo на сегодняшний день являются одним из стандартов качества, символом глубоких научных исследований, передовых разработок и технологий в производстве литиевых элементов питания. Продолжающиеся уже более двух десятков лет исследования и постоянное совершенствование процессов производства, позволили компании Sanyo Electric гарантировать для литиевых элементов Sanyo высочайшие эксплуатационные характеристики.
Основные научно-исследовательские центры компании Sanyo Electric размещены в Японии. Там же и производится основная часть литиевых элементов питания.
Как разработка, так и производство высококачественных литиевых элементов питания требуют достаточно серьезных производственных мощностей и дорогостоящих научных изысканий.
Компания Sanyo активно включилась в этот процесс, производя литиевые элементы не только для торговли под своей торговой маркой, но и по заказу других известных производителей элементов питания, фотографического и электронного оборудования.
В разработке и выпуске аккумуляторов компания Sanyo также занимает одну из лидирующих позиций в мире. Первая в мире промышленная технология производства никель-кадмиевых герметичных аккумуляторов разработана инженерами компании Sanyo ещё в 1963 году. С тех пор никель-кадмиевые аккумуляторы Sanyo Cadnica, применяемые в самых разнообразных устройствах и приборах, неоднократно подтверждали славу мощных и надежных вторичных источников питания. В последствии в производственной программе компании Sanyo появились и другие типы герметичных аккумуляторов - в первую очередь никель-металлгидридные и литий-ионные, столь же надежные, емкие и качественные, как и другие изделия под маркой Sanyo.
office.hi-fi.ru
www.photoweb.ru
PANASONIC
В 1918 году Коносукэ Мацусита решил, что наконец-то наступило время попробовать силы в самостоятельном бизнесе. Он основывает маленькую фирму.
Мацусита не стал особо ломать голову над названием, выбрав самое простое и разумное - "Мацусита Дэнки". Хотя планы у молодого бизнесмена были самыми масштабными, на первых порах приходилось обходиться очень узким кругом сотрудников. Ими стали бывший сослуживец и брат жены, позже ставший президентом компании Sanyo. Наиболее перспективным в то время казалось производство товаров, связанных с электричеством. В качестве мастерской использовался небольшой жилой домик Коносукэ. Создание патронов для электроламп должно было стать беспроигрышным. Однако обстановка складывалась крайне неблагоприятно. Первая проданная партия, насчитывающая всего сотню электрических патронов, грозила стать последней. Впереди замаячил призрак неминуемого разорения.
К счастью, одной из фирм срочно понадобилось около тысячи подставок для вентиляторов. Хотя это было не совсем то, что задумывалось, фирма смогла заработать в полную силу. Теперь можно было расширяться, не опасаясь последствий. Для производства электротоваров потребовалось снять в аренду целый дом. Сложная ситуация в мировой экономике усугубляла и без того непростое положение японского мелкого производителя. Чтобы продать готовый продукт, требовалась смекалка и находчивость. Мацусита принялся за выпуск штепсельных вилок.
Сегодня ассортимент Matsushita Electric Industrial Co., Ltd. (торговые марки Panasonic, Technics, National) очень разнообразен. Важнейшей отличительной чертой деятельности Panasonic является развитие и совершенствование по всем направлениям, что обеспечивает широкий ассортимент производимых электрических и электронных товаров. Panasonic - это телевизоры, музыкальные центры Hi-Fi, автомобильные магнитолы, видеомагнитофоны, видеокамеры SLIM VISION, мультистандартные видеоплееры, лазерные диски DVD, цифровые домашние кинотеатры DVD-A100EU, мини-системы, 5-дисковые CD-чейнджеры, рессиверы для домашних кинотеатров (марка TECHICS), профессиональные наушники для мониторинга, автомобильные магнитолы с контроллером CD-чейнджера, автомагнитолы с проигрывателем компакт-дисков, беспроводные телефоны с возможностью подключения к Интернету, сотовые телефоны, трехдверные холодильники, пылесосы и кондиционеры, многофункциональные аппараты для дома и офиса, миниатюрные цифровые фото- и видеокамеры. Этот список можно продолжать.
Создавая многочисленные электронные устройства, инженеры компании стараются не забывать о мелочах. Одной из таких мелочей, являются привычные нам батарейки.
Батарейками занимается Matsushita Battery Industrial являющаяся производителем батареек под марками National и Panasonic. Она уже выпустила стомиллиардную электробатарейку с момента начала производства.
Этот рекорд в объемах производства совпал с 70-летней годовщиной начала производства батареек группой компаний Matsushita. Из этих ста миллиардов 83,4 млрд. (83%) составляют марганцевые батарейки, а 16,6 млрд. (17%) алкалиновые (щелочные) батарейки. Около 40% батареек было произведено в Японии, остальные - за рубежом.
История производства батареек компанией Matsushita начинается с 1931 года, когда основатель компании Коносукэ Мацусита наладил выпуск фонарей на батареях и начал самостоятельно производить батарейки.
Пройдя путь от разработки технологии производства электрической лампы в 1927 году и производства первой собственной сухой батарейки в 1931 году, компания становится одним из мировых лидеров в производстве различных батарей для разнообразного электронного оборудования того времени.
Matsushita Battery Industrial Co., Ltd. производит следующие продукты: марганцевые батарейки, Щелочные батарейки, Литиевые батарейки, Никель-Кадмиевые и Метал-Гидридные аккумуляторы, Литиевые аккумуляторы, Автомобильные аккумуляторы, и другие источники энергии.
www.klimat-ingener.ru
www.compulenta.ru
TOSHIBA
История многопрофильной компании Toshiba ведет свой отсчет с 1875 года, когда изобретатель Хисашиге Танака (1799-1881 г.г.) основал первую в Японии фирму по производству телеграфного оборудования - Tanaka Seizo-sho (Tanaka Engineering Works). Под названием Shibaura Engineering Works эта фирма очень быстро сделалась крупнейшим в Японии изготовителем оборудования для электроэнергетики.
В 1890 году в Токио была основана фирма, позднее получившая название Tokyo Denki (Tokyo Electric Company), которая, начав с производства электрических ламп накаливания, стала крупнейшим в Японии производителем электропотребительских товаров.
Объединение фирм Shibaura Engineering Works и Tokyo Electric Company, произошедшее в 1939 году, дало начало компании Tokyo Shibaura Denki (Tokyo Shibaura Electric Company), в 1978 году взявшей в качестве официального имени соединение начальных букв двух первых слов названия - TOSHIBA (TOkyo SHIBAura).
Столь длинная история Toshiba на каждом этапе была насыщена инновациями: создание в конце XIX века первых японских электрических ламп накаливания, первых японских асинхронных двигателей и самого большого в Японии электрогенератора; производство первых в Японии ренгеновских трубок в 1915 году; изобретение в 1921 году двойной нити электрической лампы накаливания, ставшее одним из шести крупнейших изобретений в технологии изготовления ламп накаливания; создание первых в Японии радиоприемников в 1924 году и начало разработки телевизионного приемника в 1928 году; выпуск первых японских стиральных машин и рефрижераторов в 1930 году; выпуск первых в Японии пылесосов в 1931 году; создание первого в Японии компьютера в 1954 году; выпуск первой японской микроволновой печи и первого японского транзисторного телевизора в 1959 году; изготовление первого в Японии ядерного генератора в 1963 году, и многое, многое другое.
В 1985 году компания Toshiba произвела свой первый портативный компьютер - модель T1100. С тех пор Toshiba - одна из лидирующих компаний на рынке ноутбуков.
Производством химических источников тока занимается дочерняя компания TOSHIBA BATTERY CO.,LTD.
www.nbook.ru
PHILIPS
Фирма PHILIPS&CO была образована в 1891 году в городе Эйндховене Герардом Филипсом, который решил освоить производство электрических лампочек. Под свою фабрику он арендовал старое промышленное здание, а его продукция шла лишь на рынок Голландии.
В 1895 году к бизнесу присоединился брат Герарда Антон, который взял на себя задачу вывести фирму на международный рынок.
В 1898 году Антон Филипс приехал в Россию, где заключил договор на поставку электролампочек для Зимнего Дворца на 50 тысяч лампочек. Так, в становлении фирмы PHILIPS на ноги ключевую роль сыграла Россия. В 1914 году он открыл в Санкт-Петербурге на Невском проспекте торговую контору фирмы.
В 1916 году PHILIPS уже продавала в России 2 миллиона электролампочек в год. В 1918 году, после переворота, отделение фирмы PHILIPS в России было закрыто.
В 1925 году PHILIPS приступила к первым опытам в телевидении. В 1935 году она осуществила первое экспериментальное телевещание, а в 1964 году выпустила на рынок первые серийные цветные телевизоры.
В 1930 году PHILIPS выпустила первый электрический патефон, в 1934 году-первый автомобильный приёмник.
www.po4emu.ru
GP
Химические источники тока производит подразделение транснациональной группы Gold Peak Industries Group - GP Batteries
Концерн GP Batteries International Limited (GPBI) - один из мировых лидеров в разработке, изготовлении и продвижении химических источников тока (батареек и малогабаритных аккумуляторов), а также изделий, гармонично дополняющих модельный ряд источников тока, таких как: зарядные устройства, фонари и пр. Недавно компания GP Batteries отметила свое сорокалетие.
GPBI входит в десятку крупнейших производителей химических источников тока в мире и занимает лидирующую позицию в Азии (за пределами Японии).
GP Batteries имеет собственные производственные и маркетинговые подразделения в 15 странах (Гонконг, Китай, Сингапур, Тайвань, Малайзия, Дания, Польша, Южная Корея, Таиланд, Франция, Германия, Италия, Англия, Канада, Россия, США).
GPBI изготавливает продукцию под собственными торговыми марками, по заказам других компаний (Private Label), а также промышленные аккумуляторы и батареи для OEM-клиентов.
GP Batteries постоянно совершенствует производство Ni-MH аккумуляторных батарей для электромобилей. Компания выиграла ряд тендеров в европейских странах на поставки данных аккумуляторов для использования в муниципальном транспорте нового поколения.
Ключевыми конкурентными преимуществами GP Batteries являются: неизменно высокое качество всей выпускаемой продукции, широкий ассортимент, разработка и внедрение технологических новинок на основе непрерывного мониторинга тенденций развития рынка элементов питания и многолетнего опыта работы компании на этом рынке.
Рост производственных мощностей компании за последнии годы позволяет с уверенностью говорить о GP Batteries как о компании, занимающей высокую строчку в мировом рейтинге производителей никель-металлгидридных аккумуляторов и зарядных устройств.
Всего компания выпускает более 500 типоразмеров элементов питания, преимущественно специальных батареек и аккумуляторов. Номенклатура непрерывно обновляется и расширяется. Никель-кадмиевые элементы вытесняются металл-гидридными, снимаются с производства менее емкие аккумуляторы, новые их типы нередко не имеют аналогов по мощности.
Расширяется производство литий-ионных аккумуляторов. Новый толчок этому курсу дало приобретение GP Batteries у фирмы Duracell литий-ионного производства в США.
Обширная номенклатура производства позволяет компании обеспечивать элементами питания промышленность, связь, транспорт. Они находят обширное применение в госструктурах и других непроизводственных организациях для работы сигнализаций, систем слежения и безопасности, в компьютерах и т.п.
Область применения элементов питания в быту растет вместе с появлением новых видов бытовой электроники и другой техники. Помимо традиционного применения в фонарях, портативных радиоприемниках, часах, аккумуляторы GP обеспечивают работу видеокамер, новых типов игрушек, фототехники, радиотелефонов, сотовых телефонов.
www.gpbatteries.ru
SONY
Начало фирме SONY положила маленькая мастерская по изготовлению коротковолновых приставок к радиоприемникам, которую открыл господин Масару Ибука. 7 мая 1946 года он и его компаньон господин Акио Морита основали в Токио компанию "Токио цусин когё" (токийскую компанию телесвязи). Она насчитывала 20 человек, а начальный капитал составил всего около 500 долларов США.
Врятли кто-то мог предсказать тогда большое будущее этому предприятию, которое испытывало острую нехватку финансовых ресурсов, не имело привлекательных товаров в своей производственной программе и непрерывно боролось с угрозой вытеснения с рынка более мощными конкурентами. Однако блестящее партнерство Масару Ибуки, технического гения фирмы, и Акио Мориты, отвечавшего за маркетинг и коммерческое воплощение дерзких проектов, превратили маленькую и никому не известную компанию в одну из крупнейших транснациональных корпораций мира. Их усилиями была образована не просто крупная компания, а фирма-новатор. Именно "Сони Корпорейшн" первой запустила в массовое производство транзисторный радиоприемник и создала первый в мире домашний видеомагнитофон. Портативный кассетник с наушниками Walkman - непременный атрибут современной молодежной культуры - тоже детище SONY, и в первую очередь лично А. Мориты. Совместно с голландским концерном PHILIPS фирма разработала и внедрила принципиально новую лазерную технологию звукозаписи на компакт-дисках. Не имеет равных вклад компании в разработку и продвижение оборудования для телевизионного вещания - от аналоговых бетакамов до камкордеров и видеомагнитофонов цифровых форматов последнего поколения. Наконец, в последнее время SONY активно создает оборудование для производства цифровых программ высокой четкости, которое уже вытесняет традиционную пленочную технологию в кино.
Именно глобальные устремления менеджеров компании, их амбициозные планы по продвижению передовых японских технологий на мировые рынки побудили принять решение переименовать фирму. В 1955 году она получила название SONY, которое, по своей сути, должно было отразить энергичный, новаторский и творческий характер корпорации.
Годы становления и успешного развития корпорации только подтвердили основные ценности компании SONY, всегда отличавшие ее от множества других японских компаний: открытость перед новыми идеями; способность гибко менять планы, учитывая реальные потребности рынка; неизменное поощрение энтузиастов и молодых талантов.
В настоящее время деятельность корпорации происходит по следующим основным направлениям: бытовая и профессиональная электроника, производство продукции в области информации и телекоммуникаций; сфера развлечений, включая производство кинофильмов, музыкальных программ и компьютерных игр; финансово-инвестиционая деятельность.
Вольта считал, что причина гальванического тока в соприкосновении металлов. Правда, при работе с элементами Вольта замечал окисление металлических пластинок, в частности цинка. Но он полагал, что это побочное явление и его можно устранить удачным расположением электродов. "Удачного" расположения ему найти так и не удалось: если не было окисления, не было и тока, а наличие тока в столбе сопровождалось химическими изменениями на электродах.
Еще раньше Вольта определил, что действие различных веществ в столбе далеко не одинаково. По силе действия их можно расположить в ряд, где больший эффект будет соответствовать металлам, наиболее удаленным в ряду друг от друга. Первый "ряд напряжений" выглядел у него так: цинк, олово, свинец, железо, латунь, бронза, медь, платина, золото, серебро, ртуть, графит, древесный уголь. Действительно, все так и получалось, но только если любая пара металлов была разделена влажным проводником. Не обращая внимания на видимые химические изменения на поверхности металлов в столбе, Вольта полагал, что при чисто металлическом, "сухом" соприкосновении возбужденные напряжения взаимно уничтожаются.
Быстрое окисление металлов в вольтовом столбе отмечали и пытались объяснить многие ученые. Окисление цинковых пластинок заметил, например, в 1800 г. Луиджи Бруньятелли из университета в Павии, первый из ученых, кому Вольта показал свой новый прибор. Позже об окислении металлов при "мокром" контакте писал другой ученый, Джованни Фабброни. Не лежат ли в основе действия вольтова столба химические реакции? Эта мысль не могла, конечно, не прийти в голову ученым. Но дальше этого предположения дело не двигалось.
Между тем "ряд напряжений" металлов, установленный Вольтой, был тождествен ряду металлов, размещенных по их сродству к кислороду. Этот ряд еще в 1792 г. составил совсем юный исследователь из Мюнхена Иоганн Риттер (1776-1810). Он определил, что ртуть вытесняется из растворов серебром, серебро - медью, медь - железом, железо - свинцом, свинец - цинком. Научные работы Риттера отвечали на самые сложные вопросы. В одном его опыте было просто доказано существование связи между химическими и электрическими явлениями. В слегка подсоленную воду он опустил цинковую и висмутовую палочки. Никаких заметных изменений с металлами не произошло. Тогда Риттер соединил эти металлы проволочкой. Спустя некоторое время цинк стал сильно окисляться, и водная окись цинка протянулась к висмуту в виде белого осадка. Риттер писал: "...когда электрическая цепь была разорвана, не было и химических действий".
В 1801 г. Риттер, а чуть позже француз Никола Готро (1753-1803) и англичанин Уильям Волластон (1766-1828) предложили химическую теорию электричества. Согласно этой теории источником электродвижущей силы в элементе служит химическое взаимодействие металлов с жидкостью, в которую они погружены. Спор о природе электродвижущей силы вольтова столба между сторонниками химической и контактной теории длился до конца XIX в.
Считается, что эксперименты Риттера положили начало научной электрохимии. До этого говорили об "электричестве от соприкосновения" без какой-либо связи с химическими явлениями. Исходя из наличия такой связи, Риттер открыл "вторичную" электродвижущую силу на электродах, погруженных в воду и подключенных к вольтову столбу. Риттер заметил, что если в течение некоторого времени пропускать ток через проводники, погруженные в заполненную водой трубку, а потом отключить их от полюсов столба и подсоединить к регистрирующему прибору, то обнаружится электрический ток, текущий в обратном направлении. Такие "вторичные столбы" не представляли практического интереса до тех пор, пока в 1859 г. Гастон Планте не изобрел хорошо известный многим свинцовый аккумулятор, основанный на этом принципе.
За свою короткую, полную лишений жизнь Риттер выполнил много исследований и в других областях, науки. Независимо от Волластона он открыл ультрафиолетовые лучи и до Зеебека - термоэлектричество. Изучал он электрические потенциалы, электрическую проводимость и выдвинул гипотезу о дискретной (прерывистой) структуре электричества. Риттер был необычайно талантлив и проницателен. К сожалению, работы его отличает путаный и торопливый стиль, и они изобилуют фантастическими гипотезами. Но если читать их внимательно и терпеливо, можно убедится, что этот молодой пылкий исследователь превосходил многих своих современников в способности подвергать сложное явление самому глубокому и систематическому анализу.
Опыты с вольтовым столбом приводили все к новым и новым открытиям. Одно из них было сделано в ходе экспериментов, которые проводили университетские физики на берегу Москвы-реки. Пользуясь электрической машиной и вольтовым столбом, профессор Петр Иванович Страхов (1757-1813) исследовал, как проходит электрический ток через речную воду и влажную землю. Опыты убедили Страхова в том, что гальваническое электричество, полученное с помощью вольтова столба, и электричество, получаемое с помощью электростатических машин, тождественны. Эту мысль Страхов проводит в своем учебнике "Краткое начертание физики", вышедшем в 1810 г. Как он пришел к ней? Прямых оснований для нее не было ни в исходных данных Вольты, ни в последующих опытах по электролизу. Заметим также, что в то время не имелось иных указателей электрического тока, кроме физиологических, - реакций лапок лягушки, например, или болезненных ощущений в пальцах, которыми исследователь касался оголенных концов столба и электрической машины. Были, правда, еще электроскопы.
Страхов занимает особое место в истории Московского университета. Окончив его, он некоторое время работал секретарем поэта М.М. Хераскова, затем стал профессором университета, а с 1805 г. был его ректором. Он организовал в университете физический кабинет. Так же как В.В. Петров в Петербурге, Страхов ввел в Москве физический практикум для студентов. Словом, начало экспериментальным работам по физике в Московском университете было положено им.
Так вот, выполняя опыты на берегу Москвы-реки, Страхов обнаружил, что, если долго пропускать электрический ток через грунт, земля вокруг положительного полюса делается сухой и прохождение тока прекращается. К сожалению, большая часть рукописей, содержащих результаты его экспериментальных и теоретических работ, погибла при пожаре Москвы в 1812 г., сам он вскоре умер, и все идеи, к которым пришел этот незаурядный ученый, так и остались неизвестными.
Эксперименты Страхова продолжил его коллега Фердинанд Фридрихович Рейсе (1778-1852), занявшийся изучением действия гальванического тока на растворы. Рейсе обнаружил, что разложение "межполюсной жидкости" на составные части под влиянием гальванического тока наблюдается всегда, каково бы ни было расстояние между полюсами. "Этот интересный результат, - писал Рейсе, - неизвестный до настоящего времени, я добыл из опытов, которые я производил на берегу Москвы-реки и на земле одного сада. Газы выделялись всегда с одинаковой скоростью на конце полюсов маленького элемента, когда они находились в наполненном водой стакане на расстоянии только одного дюйма или когда они были удалены друг от друга слоем воды в двести шагов или слоем влажной земли в десять, двадцать или больше аршин".
Механизм электролиза Рейсе объяснял тем, что "одна из двух составных частей молекулы, разлагаемой действием гальванического тока, переносится от одного полюса к другому через межполюсную жидкость". Если между полюсами поместить какое-либо постороннее тело, например землю, то она не будет препятствовать прохождению тока и разложению воды.
В 1807г. Рейсе модифицировал опыт Никольсона по разложению воды. Чтобы добиться разделения продуктов электролиза, Рейсе заполнил толченым кварцем среднюю часть U-образного электролизера-трубки. Он заметил, что приложение внешнего большого напряжения к электродам приводит к перемещению воды в трубке в сторону отрицательного полюса. При продолжительном пропускании тока устанавливалась постоянная и значительная (до 20 сантиметров) разность уровней жидкости. Перенос жидкости под действием внешнего электрического тока, наблюдавшийся в пористых телах, получил название электроосмоса.
Схема опытов Рейсса по электроосмосу и электрофорезу
Рейсе продолжал видоизменять опыты по электролизу. Он вставлял во влажную глину две стеклянные трубки, заполненные водой, в трубки погружал электроды. После включения тока наряду с электроосмосом наблюдалось еще одно новое явление - движение оторвавшихся частичек глины в противоположном направлении - к положительному полюсу. Явление перемещения частиц твердой фазы в жидкости под влиянием тока было названо электрофорезом.
Рейсе сделал сообщение в университете об открытых им явлениях. Через два года вышли его статьи, в которых были подробно описаны электроосмос и электрофорез. В этих явлениях проявлялась связь между электрическим током и относительным перемещением твердой и жидкой фазы. Понимание такой связи было, однако, неполным, так как явления, противоположные электроосмосу и электрофорезу по характеру причинно-следственной связи, то есть возникновение электрического потенциала при движении жидкости или твердых частиц, были открыты лишь спустя полвека.
Эффект, противоположный электроосмосу, обнаружил Георг Квинке (1834-1924), профессор Берлинского университета. В его опытах при протекании жидкости через пористую диафрагму появлялась разность потенциалов между двумя электродами, помещенными по разным сторонам диафрагмы. Явление получило название потенциала течения. Тогда же (а именно в 1859г.) Квинке предположил, что поверхность твердого тела заряжается одним знаком, а прилегающий слой жидкости - другим. Эта схема помогала объяснить относительное движение жидкости и частиц твердой фазы под действием тока, а также появление потенциала при протекании жидкости через пористую диафрагму. В дальнейшем эта идея привела к открытию удивительной границы на разделе фаз - двойного электрического слоя.
Схема возникновения потенциалов течения и оседания
Возникновение же разности потенциалов под действием механического движения твердых частиц в жидкости наблюдал в 1880г. немецкий физик Фридрих Дорн (1848-1916). Оно было названо эффектом Дорна, или потенциалом оседания.
В 1861г. английский исследователь Томас Грэм (1805-1869), один из основателей коллоидной химии, применил диализ для очистки коллоидных систем. Очищаемый раствор он наливал в сосуд, который был отделен от другого сосуда с чистой водой мембраной из пергамента, целлюлозы, коллодия или керамическим фильтром. В результате диффузии все растворимые низкомолекулярные компоненты удалялись через мембрану во внешний раствор. Как выяснилось, диализ существенно ускоряется благодаря наложению внешнего электрического тока. Успехи химии белков и полимеров в немалой степени связаны с применением электродиализа для выделения ионов из соответствующих растворов. Электродиализ используют для опреснения морской воды, очистки речной и озерной воды, очистки промышленных стоков, шахтной и рудничной воды, фракционирования вакцин, сывороток, для удаления солей из суспензий, паст, минералов. Двухкамерные, трехкамерные, многокамерные электродиализаторы имеют сложную конструкцию. Но схема опреснения морской воды, очистки речной воды либо технологических вод в принципе проста. Подлежащую очистке воду подают в среднюю камеру электродиализатора. В электродные пространства через мембраны поступают ионы: катионы - в катодную камеру, анионы - в анодную. Очищенная вода постепенно переливается в другую камеру, где подвергается новой очистке. Особенно эффективен электродиализ с использованием ионитовых мембран. В зависимости от знака электрического заряда на их поверхности эти мембраны пропускают преимущественно или катионы или анионы.
Через семьдесят лет, после того как Рейсе открыл электрокинетические явления, электроосмос был применен на практике для сушки торфа, а затем и для сушки древесины. С 60-х годов 20 века электроосмос используют для сушки и укрепления грунтов при постройке зданий, для борьбы с оползнями при строительстве плотин, для понижения уровня грунтовых вод, для ремонта железнодорожного полотна и осушки зданий. Не остается без дела и электрофорез, служащий для разделения сложных органических и высокомолекулярных компонентов раствора. Он находит применение, когда появляется необходимость в получении ровных и прочных покрытий на металлах, которые для этой цели погружают в качестве электродов в суспензию. Таковы, например, декоративные и антикоррозионные покрытия из лакокрасочных композиций, электроизоляционные пленки.
В земной коре через грунты и горные породы текут подземные воды, а им сопутствуют так называемые потенциалы течения, которыми пользуются геофизики для поиска полезных ископаемых, картографии подземных вод и отыскания путей просачивания воды через плотины. Потенциалы течения возникают при транспортировке жидкого топлива, при заполнении резервуаров, цистерн, нефтеналивных судов, бензобаков самолетов. Когда по трубам течет топливо, на концах трубопроводов возникают достаточно высокие разности потенциалов, из-за которых на нефтеналивных судах случались грандиозные пожары. Заземление трубопроводов и приемных резервуаров, к сожалению, не устраняет опасности, а способствует еще большему разделению обкладок двойного электрического слоя. Приходится добавлять в горючее вещества, увеличивающие токи утечки. Есть еще потенциалы оседания - причина грозовых разрядов в атмосфере.
Широко пользуются электрохимическими методами медицина. Когда кровь течет через капилляры кровеносной системы, возникают потенциалы течения, являющиеся одним из источников биопотенциалов. Установлено, к примеру, что один из пиков электрокардиограммы обусловлен возникновением потенциалов течения крови в коронарных сосудах сердца. Эти потенциалы измеряют в кардиологических клиниках и лабораториях. В медицине широко применяют электрофорез. Он используется для разделения белков, аминокислот, антибиотиков, ферментов, антител, для диагностики и контроля за ходом болезни. Распространен и ионофорез - метод введения лекарственных веществ в организм через кожу постоянным током. Известный аппарат "искусственная почка", к которому подключают больного при острой почечной недостаточности, основан на явлении электродиализа. Кровь протекает в узком зазоре между двумя мембранами, омываемыми снаружи физиологическим раствором. Благодаря большой площади мембран и наложенному электрическому полю из крови удаляются шлаки - продукты обмена и распада тканей.

Фарадей
С лета 1832 г. Фарадей все больше и больше размышлял над химическим действием электрического тока. Фарадей чувствовал, что здесь должно быть заключено нечто глубокое, и решил во что бы то ни стало докопаться до этих глубин. Первые опыты были простыми, но они позволили Фарадею определить программу и последовательность исследований.
Вначале он выяснил наличие химического действия электрического тока. Маленькую куркумовую бумажку, смоченную раствором сульфата натрия, он поместил одним концом против острия разрядного провода электрической машины. Другой ее конец соединил со вторым проводом машины. "После сорока или пятидесяти оборотов машины конец бумажки, обращенный к острию, был окрашен благодаря присутствию свободной щелочи", - отметил он. Но вызван ли обнаруженный эффект только действием тока? Видоизменяя объект исследования, Фарадей проделал опыт, в котором "не допускалось металлического соединения с разлагаемым веществом". На листочек куркумовой бумажки был положен такой же листочек лакмусовой бумажки, обе были смочены раствором сульфата натрия. На некотором расстоянии от концов бумажек были укреплены острия, одно из которых было связано с кондуктором машины, а другое - с разрядным проводом. Через некоторое время после вращения машины "делалось очевидным разложение, так как конец лакмусовой бумажки краснел от выделившейся кислоты, а конец куркумовой окрашивался от подобного же и одновременного выделения щелочи". Фарадей записывает: "Кислота собирается около отрицательного конца, а щелочь - около положительного".
Майкл Фарадей (1791-1867), сын кузнеца, учился в школе для бедных детей; там он научился читать, считать и писать. В девять лет ему пришлось работать разносчиком газет. Через некоторое время отец отдал его на семь лет в ученики переплетчика. "Будучи учеником, - вспоминал фарадей, - я любил читать научные книги, которые переплетал. Из них мне нравились "Беседы о химии" Марсе и статьи по электричеству в Британской энциклопедии". Когда ему исполнилось девятнадцать лет, он случайно узнал о лекциях по естествознанию некоего мистера Татума. Посетив 13 лекций, он решил сам заняться наукой. Ему определенно везло. Как-то в переплетную мастерскую, где работал Фарадей, зашел Дэнс, член Королевского института. Поговорив с Фарадеем, Дэнс понял, что имеет дело с незаурядным человеком. Он принес Майклу билеты на цикл лекций по химии, которые читал Дэви. Лекции Дэви явились поворотным пунктом в жизни Фарадея. "...Желание заниматься научной работой, хотя бы самой примитивной, побудило меня, незнакомого со светскими правилами, написать президенту Лондонского Королевского общества сэру Джозефу Бэнксу. Вполне естественно было затем узнать у привратника, что моя просьба оставлена без ответа". По совету того же Дэнса Фарадей пишет письмо своему кумиру Дэви, приложив к нему как доказательство серьезности своих стремлений к науке тетради с его лекциями. Через два месяца они встретились. Но Дэви ничего не мог сделать для Фарадея. Помог случай, опять случай! Неосторожный Дэви поранил в своих опытах глаза и, вспомнив о Фарадее, пригласил его на время секретарем. Познания, аккуратность и старательность юноши произвели на Дэви большое впечатление, и он упросил администрацию принять Фарадея на работу в Королевский институт. В конце 1813г. Дэви отправляется в Европу. Майкл сопровождает его в качестве лаборанта, секретаря и слуги. Леди Дэви требует, чтобы он прогуливал ее собачку, третирует его. Если бы она знала, что через 150 лет ее будут вспоминать только благодаря этому молчаливому юноше, заботившемуся о походной лаборатории ее мужа! Тихий лаборант жадно впитывает опыт знаменитого химика, своими глазами видит великих - Вольту, Ампера, Гей-Люссака, внимает их словам. Вернувшись на родину, молодой Фарадей много работает. Первые публикации, первые самостоятельные опыты по электричеству и химии. Пылко влюбляется. И не в пример несчастному своему учителю, не в пример тому же Амперу или Томпсону живет счастливой семейной жизнью. Через 25 лет после женитьбы Фарадей вспомнил первую свою профессию и собственноручно переплел в один альбом все многочисленные свои дипломы. Их оказалось 95. В альбом он вписал: "Среди этих воспоминаний и отличий я ставлю дату события, которое больше, чем все они, было для меня источником гордости и счастья. Мы поженились 12 июня 1821 года". Ради науки Фарадей почти целиком ограничил свой мир двумя этажами Королевского института: внизу лаборатория, вверху квартира. Работоспособность его была необыкновенной. Спал он не более пяти часов в сутки, а все остальное время работал.
8 сентября 1832 г. (день этот отмечен его записью) Фарадей заметил, что площадь окрашенных участков на бумажках зависела от времени пропускания тока. Он надеялся, что выяснение количественных соотношений в процессах воздействия тока на растворы и получение тока во время химических реакций прольет свет на механизм связи химических и электрических явлений. Той связи, которой обязан своим появлением химический источник тока - вольтов столб, позволивший изучить свойства тока, открыть его магнитное действие, электромагнитное вращение и "превращение магнетизма в электричество". Когда Фарадей узнал, что Эрстед обнаружил отклонение магнитной стрелки вблизи проводника, через который проходит электрический ток, он сконструировал специальный прибор и доказал, что существует и обратное явление - проводник с током движется вокруг магнита (электромагнитное вращение). Первое большое открытие! 1 мая 1823 г. 29 членов Королевского общества (среди них не было Дэви!) рекомендовали его в члены этого общества. В начале 1824г. Фарадей был избран, год спустя возглавил лабораторию Королевского института. Он продолжал упорно экспериментировать, пытаясь "получить ток из магнетизма", но только в 1831 г. добился успеха: он обнаружил, что прохождение электрического тока по одной проволочной катушке может вызвать на короткое время появление тока в другой катушке, если эти катушки связаны общим железным кольцом. Он чувствует, что его "исследовательская удочка зацепилась за что-то крупное", и наконец, через полтора месяца получает электрический ток с помощью только магнита. Ток появляется на концах проволочной спирали, намотанной на магнитное кольцо, в которое вдвигался другой магнит.
Открыв новое в мире электрических явлений, Фарадей проложил путь к техническим вершинам современной цивилизации. В сущности, был найден простой способ получения электрического тока. Почти вся электрическая энергия, которой сегодня пользуется человек, получена этим способом. Фарадей открыл дверь в век электричества. Энгельс назвал его "величайшим до нашего времени исследователем в области электричества". Эти слова так же справедливы сегодня, как и тогда, когда они были сказаны.
Как-то раз, придя в лабораторию, Фарадей на листках бумаги написал вопросы, относящиеся к химическому действию тока и подлежащие разрешению. На первом листке значилось: "тождество электричеств". Фарадей так всегда приступал к изучению какой-либо проблемы: составлял список вопросов в том порядке, в каком намеревался проводить опыты. По ходу выполнения опытов он делал пометки на листках и откладывал их в сторону. В этот день, как он писал потом, ход исследований по электричеству привел его "к такому моменту, когда для продолжения исследований стало существенно, чтобы не оставалось никаких сомнений относительно того, тождественны или различны отдельные виды электричества, возбуждаемые различными способами". Видов было уже пять. Человечеству издавна было знакомо "животное электричество", присущее некоторым рыбам и морским животным. Фарадей даже держал в лаборатории живого ската, показывая желающим этот источник тока. Столь же давно люди наблюдали искры, получающиеся благодаря трению изоляторов. Во времена Фарадея это делалось в электростатических машинах. Со времен благодаря Гальвани и Вольту стал известен гальванизм. Он действовал на лапку лягушки, вызывал нагревание проводников, разлагал соли, кислоты и щелочи, действовал на магнитную стрелку. Недавно Зеебек открыл термоэлектричество - четвертый источник тока. И вот теперь сам Фарадей открыл пятый способ получения тока - магнитоэлектричество.

Лаборатория Фарадея
Но что же такое электричество? В чем его сущность? Одни ученые, например Вольта, Риттер, Волластон, Страхов, считали все известные им виды электричества тождественными, другие, в частности Дэви, - различными. Некоторым казалось: то, что вырабатывает вольтов столб, электричеством назвать нельзя - в этом случае надо говорить о гальванизме. В учебных пособиях по физике в начале XIX в. можно было встретить независимые разделы "Электричество" и "Гальванизм". И вот теперь пять видов электричества. Одна у них природа или нет? Разнородные явления гальванизм и магнитоэлектричество или однородные?
Если Фарадей направлял свой интерес на какую-нибудь проблему, он уже не прекращался думать о ней и работал до тех пор, пока не находил ответа. Биограф Фарадея английский физик Джон Тиндаль писал о нем: "Он раздражался, когда ему приходилось опираться на факты, хотя бы слегка подверженные сомнению. Он ненавидел так называемое сомнительное знание и всегда старался превратить его в знание несомненное или в совершенное незнание". Прежде всего, Фарадей отмечает виды воздействия электрического тока. Их он находит восемь: физиологическое действие, отклонение магнитной стрелки, способность к намагничиванию, искра, нагревательная способность, химическое действие, притяжение и отталкивание, разряд через нагретый воздух. "Моя задача, - пишет Фарадей, - состоит в сравнении электричества от различных источников в отношении способности производить эти действия".
Осуществляя простые, но тщательно продуманные опыты, сопоставляя обычное и гальваническое электричество, Фарадей приходит к выводу, что способность обычного электричества разряжаться через воздух, в особенности нагретый, обусловлена его высоким напряжением. Напряжение между полюсами вольтовой батареи мало. Но если напряжение увеличить, сделав батарею из 140 пластин и подогреть воздух пламенем спиртовки (а еще лучше сделать его разреженным), разряд произойдет легко. Подобные опыты Фарадей делает и с другими видами электричества. Результаты опытов записываются в таблицу. Общий вывод формулируется в работе "Экспериментальные исследования по электричеству": "...Отдельные виды электричества тождественны по своей природе, каков бы ни был их источник. Явления, присущие пяти перечисленным типам или видам электричества, различаются друг от друга не по своей природе, а лишь количественно".
15 декабря 1832г. Фарадей представляет Королевскому обществу пробную статью о своих опытах и выводах. В январе 1833г. он докладывает Обществу о своих экспериментах, которые привели его к выводу о единой природе всех видов электричества, каково бы ни было их происхождение. Ибо все они могут производить все присущие электричеству действия - химические, физиологические, магнитные, световые, механические.
Фарадей был твердо убежден в единстве сил природы. Эта теоретическая предпосылка и побудила его добиваться "превращения магнетизма в электричество". Той же мыслью он руководствовался и в последующих своих исследованиях. Он как-то сказал: "Искусство экспериментатора состоит в том, чтобы уметь задавать природе вопросы и понимать ее ответы". Сам Фарадей владел этим искусством в совершенстве.
Начав изучать какой-либо вопрос, Фарадей с гениальной способностью определял ключевые направления поиска. Методичность и трезвость его экспериментальной техники удивляют и заслуживают подражания. Фарадея называли "королем эксперимента". Простой опыт часто служил для него исходным пунктом, отправляясь от которого его мысль доходила до познания тайны явления. Даже когда он, казалось бы, повторял опыты других, его работы приобретали фундаментальное значение для науки. Он никогда не предвосхищал результата эксперимента, он говорил: "Я не знаю". Фарадей доверял только фактам.
11 июля 1832г. он устанавливает, что бумага, смоченная раствором йодистого калия и крахмала, весьма чувствительна к направлению электрического тока от вольтова столба.
6 и 8 сентября. Под действием тока на индикаторные бумажки концы их, близкие к "входу и выходу тока", окрашиваются...
Но не сам факт химического действия интересует Фарадея. Существующие теории электролиза не предсказывают химического действия в определенных зонах.
Гротгус, выдвинув замечательную мысль о полярности молекулы воды, предположил, что отдельные ионы существуют лишь короткое время, в течение которого молекулы ими обмениваются. Если бы это было так, индикаторная бумага окрашивалась бы вся, так как в растворе, через который пропускали ток, существует как кислород, так и водород. Дэви вслед за Гротгусом предполагал, что кислород притягивается положительным электродом, а водород - отрицательным. Но и тогда бумажка окрашивалась бы по всей своей длине. А тут - только у электродов! Поразительно! Что это значит? Где же все-таки происходит химическое изменение под влиянием тока - в объеме раствора или на электродах? Когда-то, еще в 1806г., Дэви провел электролиз сульфата калия в двух агатовых чашках, соединенных бумажкой, смоченной этими же растворами. Через некоторое время он обнаружил в одной чашке едкое кали, а в другой - серную кислоту. Фарадей понимает, что он должен радикально изменить опыт Дэви и выяснить, где, в каком месте происходит образование кислоты и щелочи, где происходит химическое превращение под действием тока и на основе полученного результата построить теорию явления. Только после этого станет ясно, что делать дальше.
22 октября был осуществлен решающий эксперимент. Фарадей изготовил электролитическую ячейку. У электродов располагались влажные индикаторные бумажки. Такие же бумажки находились у геля - твердообразной системы, образованной при коагуляции коллоидного раствора, содержащего соль - сульфат калия. Все это прокладывалось чистым гелем, который проводит ток как обыкновенный раствор. Пропуская ток через такую ячейку, Фарадей увидел, что индикаторные бумажки окрашивались только у электродов. Причем лакмусовая бумажка показывала, что у рядом расположенного электрода образуется кислота, а куркумовая - что у другого электрода образуется щелочь. Бумажки, находившиеся у геля, содержащего соль, которая при разложении дает продукты кислого и щелочного характера, и расположенные в середине ячейки, не окрашивались. Это значило, что электрохимическое действие происходит только у электродов. Вот разница между электрохимическими реакциями и просто химическими, идущими в объеме раствора.
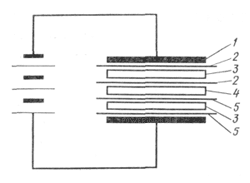
Электрохимический прибор Фарадея, показывавший, что электрохимическое действие наблюдается только у электродов: 1 - электрод; 2 - лакмусовая бумага; 3 - чистый гель; 4 - гель, содержащий соль; 5 - куркумовая бумага.
Теперь можно писать новую теорию электролиза. Прежде всего говорить о притяжении полюсов, как это предполагал Дэви, нет никаких оснований. Жидкости, поддающиеся электролизу, состоят из частиц, имеющих противоположные заряды. Под действием электрического тока частица, связанная с другой в молекулу, испытывает действие других противоположно заряженных частиц и вступает с ними в соединение. Путем таких перескоков и обменов частица движется вперед. Движется до тех пор, пока впереди есть противоположно заряженные частицы, с которыми она может соединиться. Только у электродов она не окружена полностью другими частицами и, следовательно, только здесь на нее действуют неуравновешенные силы. Здесь частица выталкивается наружу, "где и выделяется".
Теория Фарадея доказывала, в каких направлениях следует вести исследования. Стало понятно, что химическое преобразование вещества происходит только у электродов. Зная место такой реакции, можно определить и даже измерить объем участвующих в ней веществ. Можно сопоставить количество выделившихся у электродов веществ с величиной тока и временем его пропускания и подойти к количественной разгадке законов электролиза.
В сентябре 1832г. Фарадей уже мог сформулировать первый закон электролиза. Экспериментальные данные не оставляли никаких сомнений в существовании зависимости между количеством электричества и величиной его химического действия. Но Фарадей не спешит. Он как всегда работает методично.
Чтобы определить зависимость между количеством электричества и объемом веществ, образующихся в результате электрохимической реакции, надо сначала выполнить кое-какие подготовительные работы.
14 сентября Фарадей доказывает, что количество электричества не зависит от напряжения. Несколько раз он повторял опыты с батареей, состоящей то из семи, то из пятнадцати лейденских банок, каждую из которых он заряжал тридцатью оборотами машины, а затем подключал батарею к электрометру. Стрелка электрометра через определенное время всегда отклонялась на пять с половиной делений. Из чего следовало, что "отклоняющая сила электрического тока прямо пропорциональна прошедшему количеству электричества независимо от напряжения последнего".
На другой день Фарадей собирает маленький, или, как он его называет, "стандартный" вольтов столб. Точно как всегда регламентирует все условия эксперимента: диаметр платиновой и цинковой проволочек, глубину их погружения в раствор, концентрацию серной кислоты в растворе. При работе с такой батареей он определяет, что при ее разряде стрелка электрометра отклоняется на пять с половиной делений за восемь отсчетов промежутков времени по хронометру. Так он определяет одинаковые количества электричества от разных источников.
Далее Фарадей обратил внимание, что величина бурого пятна, расплывающегося на пропитанной раствором йодистого калия фильтровальной бумаге вокруг прижатой к ней платиновой проволоки, одинакова, если пропускать одно и то же количество электричества от разных источников. В этот день он убедился, что величины пятна (то есть величина химического действия тока) прямо пропорциональны времени пропускания тока, иначе говоря, количеству электричества. Вот она, та закономерность, которую он искал. Но пока Фарадей записывает ее как результат опыта. По его мнению, сделанного еще недостаточно. Химическое действие тока может проявляться не в одном лишь изменении цвета индикаторной бумажки. Под воздействием тока происходит разложение воды, водных растворов, ток осаждает и растворяет металлы. Как же будет обстоять дело в этих случаях?
Более двух месяцев Фарадей не делает никаких опытов. Он размышляет. Наконец, 10 декабря Фарадей записывает закон электрохимического разложения, первый закон электролиза: "... Химическая сила... прямо пропорциональна абсолютному количеству прошедшего электричества".
После этого дня еще полтора года Фарадей посвящает электрохимии. Его мысли сосредоточиваются на выяснении суммарной закономерности при химическом действии, сопровождающем прохождение тока. Он начинает эксперименты с различными соединениями, чтобы проверить закон, который, как он теперь уверен, должен выполняться всегда и везде. Весной 1833г. Фарадей разрабатывает более десятка различных модификаций нового прибора, названного им вольтаметром. Такой прибор позволяет измерять количество выделяющегося при электрохимической реакции газа, а также потерю или увеличение массы электрода.
Фарадей погружает две платиновые проволочки в слегка подкисленную воду, соединяет их с полюсами батареи и пропускает через них электрический ток. На положительном электроде выделяется кислород, на отрицательном - водород. Как же собрать и измерить объемы этих газов? Фарадей помещает проволочки в опрокинутые и заполненные раствором трубки. Часть газа, выделяющаяся на проволочках вне трубок, не попадает в них. Это приводит к довольно большой ошибке при измерениях. Поэтому Фарадей делает еще один довольно простой и удачный вариант вольтаметра. Это стеклянная трубка, в которую впаян платиновый электрод. Весь выделившийся газ собирается в верхней части трубки. Трубка предварительно проградуирована, и поэтому количество образовавшегося газа можно сопоставить с количеством электричества. Фарадей опускает в чашку два таких вольтаметра и проводит электролиз воды, собирая в одной трубке кислород, а в другой - водород. Далее он устанавливает, что на аноде, то есть на положительном электроде, почти всегда выделяется кислород. А на катоде, отрицательном электроде, - водород, если раствором служит кислота или, скажем, азотнокислая соль натрия. Когда в раствор входят азотнокислые соли других металлов, например ртути, меди или серебра, то на аноде тоже образуется кислород, а на катоде - соответственно ртуть, медь либо серебро. Чтобы определить количество выделившихся на отрицательном электроде ртути, меди, серебра или другого металла, Фарадей создает другие вольтаметры. В сосуд помещался металлический электрод, который предварительно взвешивался, или маленькая чашечка, куда капала ртуть с металлического электрода и которую можно было потом взвесить. Так определялось количество ртути, меди, серебра или другого металла, выделявшегося на отрицательном электроде. В качестве анода брался тот же "газовый" вольтаметр. Он заполнялся раствором и погружался в сосуд.

Один из вольтаметров Фарадея
До конца сентября 1833 г. Фарадей работал с вольтаметрами. Он уже выполнил более трехсот опытов. Он изучил электрохимическое поведение и продукты разложения при электролизе 130 различных веществ. И все же необходимо выяснить, влияют ли размеры электрода на процесс электрохимического разложения.
Еще весной Фарадей последовательно соединил два вольтаметра с разными по площади электродами. Количество продуктов разложения в обоих сосудах оказалось одинаковым. "Напряжение не оказывает влияния на результаты, - записывает он, - если количество электричества остается одинаковым". В августе Фарадей поместил два платиновых электрода в одну трубку и начал электролиз. В трубке стала собираться смесь водорода и кислорода. После отключения тока объем газов вдруг начал уменьшаться и вскоре газы полностью исчезли. Так была открыта способность платины вызывать соединение кислорода и водорода при комнатной температуре.
10 и 17 января 1833г. Фарадей докладывает Королевскому обществу результаты своей работы по установлению тождества различных видов электричества. Спустя пять месяцев, 20 июня, он знакомит своих коллег с предварительными результатами исследований по электрохимическому разложению. "Для одного и того же количества электричества, - говорит он, - сумма электрохимических действий есть также величина постоянная, то есть она всегда эквивалентна стандартному химическому действию, основанному на обычном химическом сродстве".
Определение количественных соотношений при электролизе имело большие теоретические и практические последствия для науки. Оно имело и мировоззренческое значение. Все меряется мерой и числом, говорили древние. "Фарадей, - писал химик Дюма, - добавил к этой античной формуле новое: все вещества, какова бы ни была их природа, вес, свойства, требуют одного и того же количества силы, чтобы связать или разорвать цепи, удерживающие их в соединении".
В середине 1833г. Фарадей почти не отвлекался на решение других проблем. Электричеству принадлежит будущее, часто говорил он, то, над чем я работаю, важнее всего. 19 сентября он записал результаты опыта (запись № 732) и окинул взглядом итоги последних экспериментов. Полностью, без всяких сомнений подтверждается ранее открытый закон: химическое действие электрического тока, то есть количество выделившихся веществ, прямо пропорционально силе тока и времени его прохождения, то есть количеству электричества. Этот первый закон электролиза потом был назван первым законом Фарадея.
Фарадея теперь занимало в электролизе другое. Электрический ток выделяет вещества и растворяет металлы, являющиеся частью химических соединений, растворы или расплавы которых подвергались электролизу. Состав же этих веществ и их количество в соединении точно известны. В любом соединении элементы содержатся в строго определенных весовых количествах, соответствующих их эквивалентам. Давно ли известный немецкий философ Иммануил Кант не признавал химию наукой, так как в его время считалось невозможным подвергать математической обработке результаты химических реакций. Но еще при жизни Канта его соотечественник Карл Венцель и шведский ученый Торберн Бергман начали разрабатывать методы весового анализа веществ. Тогда же немецкий химик Иеремия Рихтер (1762-1807) в своей докторской диссертации "О применении математики в химии" продемонстрировал количественный состав различных веществ, а в 1793г. на основе понятия эквивалента, введенного Кавендишем, вывел закон эквивалентов. Под эквивалентом понималось такое количество вещества, которое соединяется с одной частью другого. Количественными анализами веществ занимались и французские химики Жозеф Пруст, Гей-Люссак, Клод Бертолле. Исходя из закона постоянства состава и полагая, что каждое качественно определенное вещество имеет строго определенный количественный состав, соотечественник Фарадея, преподаватель физики и математики из Манчестера Джон Дальтон (1766-1844) в 1803г. установил один из основных законов химии - закон кратных отношений. Берцелиус показал, что и органические вещества подчиняются этому закону. Дальтон сделал первую попытку составить таблицу "атомных весов" элементов и сложных соединений. И снова Берцелиус продолжил его работу.
Определить числовые значения химических эквивалентов не трудно, если известен процентный состав данного вещества в соединении и эквивалент другого вещества. Так, если эквивалентный вес водорода принять за 1, то эквивалентный вес кислорода будет равен 8, меди - 32 и так далее. Химический эквивалент, таким образом, численно равен отношению атомного веса элемента к его валентности в данном соединении.
Что же происходит при разложении химических веществ электрическим током? Последние месяцы Фарадей посвятил количественному изучению продуктов электролиза воды, различных кислот, растворов солеи и расплавов. Оказалось, что одно и то же количество электричества выделяет кислорода в 8 раз больше, чем водорода (по массе). Но такое соотношение равно соотношению химических эквивалентов водорода и кислорода. То же самое получалось и с другими соединениями и элементами. Весовой состав продуктов реакции Фарадей проверял в самых разных условиях - изменял концентрацию растворов, полярность, материал электродов. Результаты оставались неизменными: "химическое действие было вполне определенным".
Фарадей ставит еще одну серию опытов - он исследует химические реакции в гальваническом элементе и доказывает, что количество электричества, получаемое от вольтова столба, соответствует эквивалентному количеству растворившегося в нем самом цинка. Из этого Фарадей заключает, что "электричество, которое разлагает определенное количество вещества, равно тому, которое выделяется при разложении того же количества вещества".
23 сентября он, наконец, записывает: "Числа, соответствующие весовым количествам вещества, в которых они выделяются, надо назвать электрохимическими эквивалентами..." Он считает, что эти эквиваленты "совпадают с обычными химическими эквивалентами и тождественны им". Сейчас мы говорим - пропорциональны. Так, для ионов водорода, кислорода, хлора, олова, свинца, йода Фарадей устанавливает следующие величины электрохимических эквивалентов: 1, 8, 36, 58, 104, 125.
Фарадей в трудном положении: электростатическая единица заряда еще не установлена, и он не может назвать количество электричества, "соединенного с частицами или атомами материи". Поэтому за единицу электричества Фарадей вынужден принять "абсолютное количество электричества". Он понимает, что это довольно большая величина. После сотен опытов он делает расчеты и устанавливает, что в одном гране (66,4 миллилитра) воды "содержится" столько электричества, сколько нужно, чтобы 800 тысяч раз зарядить его лейденскую батарею из 15 банок 30 оборотами машины, и что это количество равносильно "весьма мощной вспышке молнии". Это было все, что в то время он мог сказать об "абсолютном количестве электричества".
Фарадей составляет таблицу электрохимических эквивалентов, называя ее "таблицей ионов", для 18 анионов и 36 катионов. Эти значения, считает он, "очень полезны для выяснения химического эквивалента или атомного веса вещества".
В январе 1834 г. он представляет Королевскому обществу свои работы по электролизу и делает о них доклады на трех заседаниях. Члены Общества удивлены работоспособностью и талантом своего коллеги. Ведь, кажется, совсем недавно (не прошло и двух с половиной лет) мир узнал об открытии индукционного тока и "получении электричества из магнетизма". И вот следующие открытия - законы электролиза!
Начав работать, Фарадей непременно доводил работу до конца. Его девиз был: "работать, заканчивать, публиковать". Своими успехами в науке он обязан не только таланту, но и волевой целеустремленности. Когда его спросили, в чем секрет его успехов, он ответил: "Очень просто: я всю жизнь учился и работал, работал и учился".
Работам Фарадея суждено было стать важнейшим звеном в цепи событий, сделавших нашим достоянием технические достижения в области электрохимии и электричества. Если работы других ученых того времени представляли собой отдельные пики, то Фарадей воздвиг целые горные цепи из взаимосвязанных и очень важных работ.
На языке современных представлений об атомах и молекулах законы электролиза Фарадея можно сформулировать так:
Пропускание одного и того же электрического заряда через электролитическую ячейку всегда приводит к количественно одинаковому химическому превращению в данной реакции. Масса вещества, выделяемого на электроде, пропорциональна количеству электричества, пропущенному через ячейку.
Для выделения на электроде одного моля вещества, которое в процессе электрохимической реакции приобретает либо теряет один электрон, необходимо пропустить через ячейку 96 485 кулонов электричества.
Эти законы имели большое значение для развития теории строения материи: они указывали на существование "атомов" электричества, связанных с атомами вещества. Так как в них отражалась количественная связь между массой вещества, выделяемого при электролизе, и необходимым для этого количеством электричества, стало возможным количественно предсказать ход определенных электрохимических процессов и экспериментально определить эквивалентные массы химических элементов. Исходя из эквивалентных масс веществ, можно рассчитать их молекулярные массы. Связав свои исследования электрических явлений с атомистическими представлениями в химии, Фарадей стал предвестником современного учения о строении атома.
Открытия Фарадея, результаты его титанической работы поражают воображение. Одной из самых поразительных работ Фарадея является исследование, проведенное им после одиннадцати с лишним тысяч экспериментов, которые он провел в течение всей своей научной жизни. Последняя запись в его лабораторном журнале сделана 12 марта 1862 г., когда Фарадею было семьдесят лет. Из нее следует, что ученый пытался определить, может ли пучок света преломляться в магнитном поле. Попытка не увенчалась успехом из-за ограниченных возможностей аппаратуры. Фарадей, однако, был уверен, что влияние магнетизма и электричества на свет должно существовать. Он оказался прав. Эффект этот обнаружил голландский физик Питер Зееман (1865-1945), за что и был в 1902 г. удостоен Нобелевской премии.
Главным направлением деятельности Фарадея было изучение тайн природы, а не их использование, тем не менее трудно переоценить то значение, которое имели законы электролиза для практики. Возможность окисления и восстановления веществ электрическим током открыла широкие перспективы как для научных исследований, так и для химической и металлургической технологии. Еще при жизни Фарадея началось использование гальванопластики, создан первый топливный элемент и изобретен свинцовый аккумулятор.
721_38
Надо сказать, что термины, которые сохранились и до наших дней, предварительно обсуждались с сорокалетним кембриджским профессором, философом и историком Реверендом Уэвеллом (1794-1866). Именно Уэвелл ввел в обиход слово "ученый", заменив им чересчур общее понятие "философ". Философы остались философами, а люди, работающие в науке, стали учеными. Ученых также называли "физиками". Но слово "физисист" с тремя свистящими не нравилось ни Фарадею, ни всем его коллегам. И все охотно приняли слово "ученый" ("сайентист").
Фарадей и Уэвелл в письмах обсуждают возможность новой терминологии и сами термины для названия элементов и деталей электрохимического процесса. Фарадей описывает явление, его физический смысл и механизм и предлагает новые термины. Уэвелл соглашается либо предлагает свои варианты. В соответствии с традицией, утвердившейся еще в эпоху Возрождения, базой для терминов являются греческий и латынь.
Именно в этих обсуждениях и родился термин "электролиз", которым было предложено называть процесс химического разложения вещества электрическим током (от греческих слов "электрон" - электричество и "лизис" - растворение). Взамен термина "полюс" вводится слово "электрод" (путь электричества), причем Фарадей предлагает различать электроды по полярности. Появляются катод (путь вниз, отрицательный электрод) и анод (путь вверх, положительный электрод). Вещество и раствор, подвергаемые электролизу, названы электролитом. Вещества, которые переносятся к аноду, получают название анионов (поднимающихся), а к катоду - катионов (опускающихся), их объединяет понятие "ионы" (идущие). Терминология была принята, и время показало, что названия выбраны удачно.
С именем Фарадея связаны единицы измерения: фарада, служащая основной единицей измерения электрической мощности в Международной системе единиц; фарадей - внесистемная единица количества электричества, равная приблизительно 9,65 • 104 кулонам, то есть стольким кулонам, сколько кулонов/молей содержится в числе Фарадея, или постоянной Фарадея, численно равной количеству электричества, прохождение которого через электролит приводит к выделению на каждом из электродов одного моля вещества. В научной литературе то и дело встречаются явление Фарадея, эффект Фарадея, закон Фарадея-Максвелла-Ленца, фарадизация, фарадметр.
Алессандро Вольта опытным путём установил ряд напряжений металлов: Zn, Pb, Sn, Fe, Cu, Ag, Au. Сила гальванического элемента оказывалась тем больше, чем дальше стояли друг от друга члены ряда. Но причина этого в те годы была неизвестна. Правда, ещё в 1797 г. немецкий учёный Иоганн Вильгельм Риттер (1776-1810), прославившийся открытием ультрафиолетовых лучей, предсказал, что в ряду напряжений металлы должны стоять в порядке уменьшения их способности соединяться с кислородом. В случае цинка и золота этот вывод не вызывал сомнений; что же касается других металлов, то надо отметить, что их чистота была не очень высока. В 1853 г. русский учёный, один из основоположников физической химии Николай Николаевич Бекетов (1827-1911) сделал в Париже сообщение на тему "Исследование над явлениями вытеснения одних элементов другими" (через шесть лет эта работа была напечатана в Харькове на русском языке). В этой работе Бекетов обобщил исследования относительно способности одних металлов вытеснять другие из растворов их солей. Самый известный пример такой реакции - вытеснение из раствора ионов меди железом (восстановление меди железом) - ещё в Средние века использовали шарлатаны, публично показывавшие "превращение" железного гвоздя в красное "золото". Давно знали и о вытеснении из раствора свинца цинком и кадмием (восстановление свинца), вытеснении (восстановлении) железа цинком и т. д. Так был составлен "вытеснительный ряд", или ряд активности, в котором каждый металл вытесняет (восстанавливает) из растворов солей все последующие, но ни один из предыдущих. Водород тоже поместили в этот ряд - он оказался перед медью; однако сам водород металлы, как правило, из раствора не вытесняет. Все металлы, стоящие в ряду левее водорода, могут вытеснять его из растворов кислот; медь, серебро, ртуть, платина, золото, расположенные правее, не вытесняют водород. Сначала Бекетов решил, что основная закономерность такова: более лёгкие металлы способны вытеснять из растворов солей металлы с большей плотностью. Но это не всегда согласовывалось с опытными данными. Непонятно было и то, как связан "вытеснительный ряд" с рядом напряжений Вольта. Со временем накапливалось всё больше свидетельств того, что некоторые "правила вытеснения" могут нарушаться. Как обнаружил Бекетов, водород под давлением 10 атм. вытесняет серебро из раствора AgNO3. Английский химик Уильям Одлинг (1829-1921) описал множество случаев подобного "обращения активности". Например, медь вытесняет олово из концентрированного подкисленного раствора SnCl2 и свинец - из кислого раствора PbCl2. Медь, олово и свинец находятся в ряду правее кадмия, однако могут вытеснять его из кипящего слабо подкисленного раствора CdCl2.
Теоретическую основу ряда активности (и ряда напряжений) заложил немецкий физикохимик Вальтер Нернст (1864-1941). Вместо качественной характеристики - "склонности" металла и его иона к тем или иным реакциям - появилась точная количественная величина, характеризующая способность каждого металла переходить в раствор в виде ионов, а также восстанавливаться из ионов до металла на электроде. Такой величиной является стандартный электродный потенциал металла, а соответствующий ряд, выстроенный в порядке изменения потенциалов, называется рядом стандартных электродных потенциалов.
Вы знаете, что если определенным образом соединить два электрода, то получится гальванический элемент. Напряжение этого элемента равно разности электродных потенциалов двух составляющих его электродов. Если известен электродный потенциал одного электрода, мы можем определить электродный потенциал другого. Обратите внимание на это "если": мы, действительно, должны знать электродный потенциал одного из электродов. Но так как абсолютное значение было не известно, приняли электродный потенциал одного из электродов равным нулю, тогда можно определить значение другого электродного потенциала. Нулевое значение дали водородному электроду. Чтобы определить стандартный электродный потенциал металла, измеряют электродвижущую силу гальванического элемента, один из электродов которого - исследуемый металл, погружённый в раствор его соли (при концентрации 1 моль/л), а второй электрод - эталонный (его ещё называют водородным). Водородный электрод изготовлен из очень пористой губчатой платины (поверхность электрода шероховатая) и опущен в раствор кислоты (концентрация ионов Н+ также равна 1 моль/л). Платиновый электрод непрерывно омывается газообразным водородом, который частично растворяется в платине. Давление водорода также должно быть стандартным - 1,013•105 Па (1 атм), а температура ровна 25 °С. Устанавливается равновесие между осажденными на платине атомами водорода и ионами водорода в растворе. На границе металл - раствор возникает разность потенциалов, которую электрохимики принимают равной нулю. Конечно, в действительности этот потенциал не равен нулю, но его значение нам неизвестно. Поэтому определение потенциала любого электрода с помощью стандартного водородного электрода имеет относительный характер; мы определяем его по отношению к условно принятому за нуль значению стандартного водородного потенциала. Стандартный электродный потенциал - основная характеристика электрода - измерен и отражен в справочной литературе. Электродные потенциалы наиболее активных металлов, реагирующих с водой, получены косвенным путём.
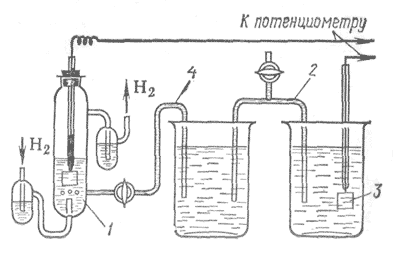
Схема установки для измерения потенциалов: 1 - водородный электрод; 2 - сифон; 3 - металлический электрод, у которого измеряется потенциал; 4 - сифон.
Обычно электродные потенциалы записывают как потенциалы восстановления ионов металлов. Самый отрицательный потенциал (-3,04 В) - у реакции Li+ + е > Li один из самых положительных (+1,68 В) - у реакции Au+ + е > Au. Это значит, что ЭДС гальванической пары литий - золото (если бы такая пара могла работать в водной среде) равнялась бы 4,72 В; для распространённой пары медь - цинк ЭДС значительно меньше и составляет 1,10 В (соответствующие потенциалы металлов равны -0,76 и +0,34 В).
Для неводных электролитов можно использовать и щелочные металлы; так устроены литиевые элементы - они дают ЭДС до 3,5 В. Конечно, потенциалы для неводных растворов другие.
Стандартные электродные потенциалы увеличиваются в ряду: Li < K < Rb < Cs < Ba < Ca < Na < Mg < Al < Mn < Cr < Zn < Fe < Cd < Co < Ni < Sn < Pb < H2 < Cu < Ag < Hg < Pt < Au. Как видно, литий "обогнал" значительно более активные щелочные металлы. В чём тут дело? Объясняется это тем, что значение стандартного электродного потенциала зависит от нескольких процессов: атомизации металла с полным разрушением его кристаллической структуры, ионизации атомов металла в газовой фазе, перехода ионов металла в водный раствор. И здесь, как у многоборцев, побеждает тот, кто наберёт наибольшую сумму баллов, а она зависит как от размера иона, так и от его заряда. Сравним, например, литий и натрий. По энергии атомизации (159 и 108 кДж/моль соответственно) впереди - натрий: для его испарения требуется меньше энергетических затрат. Меньше энергии необходимо и для ионизации натрия - 496 кДж/моль (для лития - 521 кДж/моль). Но зато при гидратации маленький ион лития резко вырывается вперёд: при гидратации ионов Li+ выделяется 531 кДж/моль, а ионов Na+ - "всего" 423 кДж/моль. По сумме "троеборья" литий занимает первое место: его растворение в воде энергетически более выгодно (на 32 кДж/моль), чем растворение натрия.
Чтобы по таблицам электродных потенциалов определить ЭДС гальванической пары в нестандартных условиях, необходимо вносить известные поправки. Так, если концентрация ионов металла в растворе отличается от 1 моль/л, для расчёта потенциала используют уравнение Нернста для системы металл раствор:
E = E° + ((R•T)/(n•F)) •lg[Men+]
где E - электродный потенциал; E° - стандартный электродный потенциал; R - универсальная газовая постоянная; T - абсолютная температура; n - валентность ионов металла; F - число Фарадея (F = 96 500 Кл); [Men+] - концентрация ионов металла, моль/л. Физический смысл E° делается понятным, когда [Men+] = 1 моль/л. Тогда lg[Men+] = 0 и E = E°. Таким образом, стандартный электродный потенциал (E°) - это потенциал, возникающий на границе металла с раствором его ионов при концентрации последних 1 моль/л. E° - это основная характеристика электрода. Уравнение Нернста демонстрирует, что электродный потенциал любого электрода может меняться в очень широких пределах. Это подтверждает член уравнения, который зависит от концентрации ионов металла.
Поместим, например, серебряный электрод (E° = +0,8 В) в раствор кислоты, где концентрация ионов Ag+ составляет 10-15 моль/л. Тогда потенциал электрода уменьшится до E = 0,8 + 0,06 • lg(10-15) = 0,8 + 0,06 • (-15) = 0,8 - 0,9 = -0,1 В, т. е. поменяет знак, и серебро начнёт вытеснять водород из кислоты! Именно поэтому идёт, в частности, реакция 2Ag + 4HI > 2H[AgI2] + H2. В крепких растворах HI концентрация ионов серебра сильно снижается из-за образования комплексных анионов [AgI2]-.
Самый отрицательный стандартный электродный потенциал у литиевого электрода Li\Li+. Это означает, что литий легче других отдает катионы в раствор и заряжается отрицательно. В ряду напряжения повышение электродного потенциала означает усиление окислительных и ослабление восстановительных свойств металлов. Выходит, что самый сильный из всех восстановителей, указанных в ряду, - это литий, а самый слабый - золото.
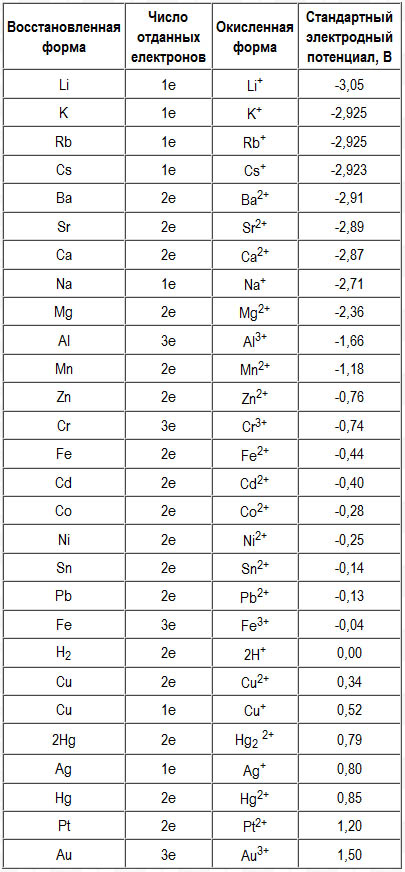
Сейчас мы уже можем предвидеть направление окислительно-восстановительного процесса, в котором участвуют металлы или их ионы. Металл из электрода, который отличается меньшим потенциалом, будет являться восстановителем по отношению к ионам всех металлов, расположенных после него в таблице потенциалов.
Но кроме электродного потенциала существует "энергия ионизации" - мера легкости, с которой атомы металлов отдают свои электроны; по ней можно судить об окислительно-восстановительных свойствах химических элементов. Кроме того, существует величина "работа выхода электрона" - энергия необходимая для отрыва электрона с поверхности металла. Каким из этих понятий следует пользоваться, зависит от того, в какой среде происходит окислительно-восстановительный процесс. Если в водных растворах - руководствуемся таблицей электродных потенциалов. Обратите внимание: последовательность элементов в ней может чуть-чуть отличаться от той, какую имеем при расположении элементов по значениям энергии ионизации (выше описывался подобный случай). Это легко объяснить. При определении потенциального скачка на границе металл - раствор играет не только электронная структура металла, но и склонность его ионов к гидратации, т. е. к взаимодействию с молекулами воды. Это означает, что ряд электродных потенциалов относится только к водным растворам. Для неводных растворителей надо учитывать склонность ионов металлов к сольватации, определять такие же ряды потенциалов для других растворов (например, для ацетоновых, бензольных и т. д.).
Итак, упорядочивание по электродному потенциалу - это тот же ряд относительной активности металлов. Только в ряду относительной активности отсутствует значение электродного потенциала. Свойства ряда относительной активности те же самые: каждый металл этого ряда в состоянии вытеснить стоящие за ним металлы из их соединения. Только никогда нельзя забывать, что утверждение это справедливо, когда концентрация ионов металлов в растворе равна единице. А этим ограничением пренебрегать не следует. Каждый, кто изучал ряд относительной активности, знает, что металлы, стоящие в этом ряду до водорода, должны вытеснять его из водородсодержащих соединений. И действительно, металлы, чьи электроды обладают более отрицательным стандартным потенциалом, чем потенциал водорода, вступают в реакцию и с азотной и с серной, и с соляной и даже уксусной кислотой. Но в не подкисленной воде концентрация ионов водорода очень мала. Это означает, что потенциал водородного электрода (это уже не будет стандартный водородный электрод), погруженного в воду, будет более отрицательным, чем стандартный водородный потенциал. Обратимся к формуле Нернста. С ее помощью можно оценить этот потенциал, если иметь в виду, что концентрация ионов водорода в чистой воде составляет 10-7 моль/л. Следует сравнивать не стандартные, а действительные (реальные) электродные потенциалы при этих условиях. Практически же водород сместился влево в ряду относительной активности элементов и занимает место перед цинком и железом, но все еще после щелочных и щелочноземельных металлов, поэтому они взаимодействуют с водой, выделяя при этом водород.
Ряд относительной активности, составлен только для электродов из металла. Но можно расширить представления об электродных потенциалах. Электродом мы назвали любой металл, погруженный в раствор, содержащий его ионы. Это по сути дела окислительно-восстановительная пара. Часто мы ее записываем так Li/Li+, Zn/Zn2+, Cu/Cu2+ и т. д. В числителе указывается восстановленная форма, а в знаменателе - окислительная. Чем не электрод и любая другая окислительно-восстановительная пара, например Fe2+/Fe3+, Cu+/Cu2+ или даже 2Cl-/Cl2. Так же, как водородный электрод, можно сконструировать и другие - из хлора, кислорода, фтора (их называют газовыми электродами). Электродные потенциалы определены не только для металлов, но и для множества окислительно-восстановительных реакций с участием как катионов, так и анионов. Это позволяет теоретически предсказывать возможность протекания разнообразных окислительно-восстановительных реакций в различных условиях. Достаточно просто погрузить инертный металл в раствор, содержащий ионы Fe2+ и Fe3+, чтобы получить Fe2+/Fe3+-электрод. И у него свой стандартный электродный потенциал. В таблицу можно внести все окислители и все восстановители. Теперь можно убрать прилагательное "электродный", будем говорить о восстановительно-окислительном потенциале, хотя, если потребуется, мы можем сконструировать и соответствующий электрод. Как видите, восстановленные и окисленные формы иногда содержат не только свободные элементы и ноны, но также и воду или ее ионы. Присутствием воды пренебрегать нельзя. Она не только среда, но и активный участник протекающих в ней окислительно-восстановительных процессов. Из данных таблицы легко понять, что сульфит-ионы SO32- - сравнительно сильные восстановители и проявляют себя в щелочной среде, перманганат-ион MnO4- этот общепризнанный окислитель, может существовать в нескольких окисленных формах, которые определяются числом принятых от молекулы окислителя электронов, а оно в свою очередь определяется кислотностью среды. В сильнокислой среде он принимает 5 электронов и восстанавливается до двухвалентного марганца, а в нейтральной или слабокислой среде - до четырехвалентного.
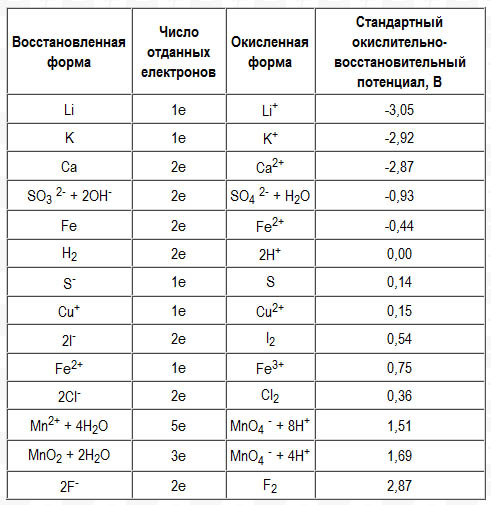
Рассмотрим конкретный пример. Пусть это будут пары 2I-/I2 и Cu+/Cu2+. В таблице против этих пар стоит соответственно 0,536 и 0,153 В. В принципе возможны два процесса:
2I- + 2Cu2+ > I2 + 2Cu+;
где иодид-ион служит восстановителем и:
I2 + 2Cu+ > 2I- + 2Cu2+;
где иод - окислитель.
Значения восстановительно-окислительных потенциалов показывают, что ионы Cu+ являются более сильным восстановителем, чем I-. Это означает, что иод растворится в растворах одновалентной меди, т. е. реально будет происходить только второй процесс. Не следует, однако, забывать, что в таблице приведены стандартные восстановительно-окислительные потенциалы, которые соответствуют случаю, когда элемент находится в растворе с концентрацией ионов этого элемента 1 моль/л или когда его окисленная и восстановленная формы имеют одинаковую концентрацию. Реальный электродный потенциал определяется из расширенного уравнения Нернста, которое называется уравнением Петерса:
E = E° + ((R•T)/(2,3•n•F)) •lg([Ox]/[Red])
где [Ox] - концентрация окисленной формы; [Red] - концентрация восстановленной формы; n - число обмененных электронов.
Например, для восстановительно-окислительного потенциала пары Fe2+/ Fe3+ получим:
E = 0,75 - 0,059 • lg( Fe3+/Fe2+ )
а для пары (Mn2+ + 4H2O)/(MnO4- + 8H+):
E = 1,51 + 0,059/5 • lg( [MnO4-][ H+]8/[ Mn2+] )
Теперь вы видите, в какой степени электродный потенциал, а значит, и окислительные свойства иона перманганата зависят от кислотности среды. Мы должны пользоваться таблицей восстановительно-окислительных потенциалов, но никогда не следует забывать и уравнения Нернста и Петерса.
Вольтов столб представляет собой батарею с множеством гальванических элементов. В столбе, о котором шла речь, гальванические элементы - серебряно-цинковые. Такие же элементы могут быть созданы и с помощью других пар металлов. Достаточно, чтобы они удачно сочетались. Не следует забывать также и о тонком влажном картоне: без него элемент не будет работать (то есть будет, конечно, если опустить два разных металла в жидкость).
Если погрузить металл в воду, его атомы будут стремиться перейти в раствор в виде положительно заряженных ионов (катионов). При этом поверхность металла заряжается отрицательно, и она начинает притягивать положительно заряженные ионы уже перешедшие в воду. Из-за отрицательного заряда поверхности металла, дальнейший переход ионов в раствор прекращается (наступает динамическое равновесие т.е. сколько перешло в раствор столько и вернулось), и на отрицательной поверхности образуется слой из положительно заряженных ионов металла, так называемый двойной электрический слой (ДЭС). Если погрузить два разных металла то они зарядятся оба, но в зависимости от активности металла, один сильнее, а другой слабее. Если соединить, эти, по-разному заряженные металлы проводником, из-за разности потенциалов потечет поток электронов от более "слабого" к более "сильному". В результате "слабый" металл (более активный) начнет растворяться (ионы переходят в раствор), а на "сильном" металле ионы восстанавливаются и оседают на поверхности.
Вольта сделал открытие: дал нам в руки гальванический элемент. Давайте и мы сконструируем гальванический элемент. Возьмем два металлических электрода, потенциалы которых значительно различаются. Поступим так же, как Даниэль, именем которого назван медно-цинковый элемент. Погрузим медный и цинковый электроды в растворы сульфатов с концентрацией ионов 1 моль/л. Стандартный потенциал цинкового электрода - 0,76 В, а медного - 0,34 В. Напряжение полученного элемента будет равно 0,34 - (-0,76) = 1,1 В. Возьмем медную проволоку, соединим оба электрода, подключим даже приборы для измерения напряжения и тока, но стрелка замерла, тока нет. Мы забыли соединить электроды и "по воде". Соединим стаканы с растворами так называемым электролитным мостом. Он представляет собой тонкую стеклянную трубочку, наполненную электролитом, например KCl. Перегородки, поставленные на обоих концах трубки, мешают свободному переходу ионов из одного раствора в другой. Ионы меди не могут самостоятельно перейти в раствор сульфата цинка и, наоборот, ионы цинка не могут перейти в раствор сульфата меди. Нельзя допустить, чтобы растворы смешались.
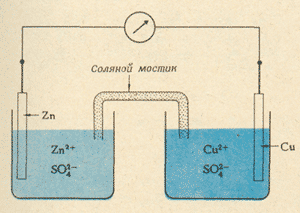
Медно-цинковый гальванический элемент с электролитным мостом
После того, как поставлен электролитный мост, гальванический элемент начинает работать: по цепи течет электрический ток. На одном электроде, там, где цинк погружен в раствор сульфата цинка, происходит постоянное растворение металла и движение ионов цинка в растворе:
Zn - 2е- > Zn2+
а на другом электроде постоянно выделяется медь:
Cu2+ + 2е > Cu
Цинк окисляется, а ионы меди восстанавливаются. Для цинка необходимо, чтобы какое-нибудь вещество приняло электроны, от которых он стремится освободиться. Ионы меди, наоборот, нуждаются в таких электронах. Электроны эти движутся по внешней цепи, по проводнику, который соединяет два электрода. Движение потока электронов по проводнику - это и есть электрический ток. Таким образом, за счет химического процесса:
Zn + Cu2+ > Zn2+ + Cu
вырабатывается электрическая энергия.
Но для чего нужен электролитный (солевой) мост. Без такого моста гальванический элемент не работает. Какие изменения происходят вблизи цинковой пластинки, когда с ее поверхности отрываются ионы цинка. Естественно, что концентрация этих ионов в растворе увеличивается. Появляется большое количество положительных ионов, которым нет антиионов в растворе. Слышали ли о таком - раствор, содержащий преимущественно одинаково заряженные ионы? Скорее всего, нет. Растворы сами по себе электронейтральны. Аналогичные изменения наступают и в объеме раствора, в который погружена медная пластинка. Здесь лишними становятся сульфатные анионы SO42-, то есть раствор заряжается отрицательно. Электроны перешли от одного электрода к другому и нарушили электронейтральность раствора. Создавшаяся разность потенциалов должна быть устранена. Этому способствует электролитный мост. По нему анионы SO42- переходят от медного электрода к цинковому в силу этой самой разности потенциалов, но если быть более точными то, в нашем случае анионы SO42- переходят в солевой мост с одной стороны а с другой стороны выходят анионы Cl- . Таким образом, налицо два потока: поток электронов по внешнему проводнику и поток ионов по электролитному мосту.
Ни медный стержень, ни ZnSO4 не являются обязательной частью этого элемента. Металлическая медь осаждается на катоде из любого другого проводника, например на платиновой проволоке, а раствор сульфата цинка в анодной камере можно заменить любой другой проводящей солью, которая не взаимодействует с цинковым анодом, например, хлоридом натрия. В качестве соляного мостика, можно использовать стеклянную U-образную трубку, содержащую какой-либо электролит типа KNO3, смешанный с агар-агаром либо желатиной, чтобы удержать электролит в трубке.
Что если оба металла погрузить в общий раствор, содержащий два вида ионов. Погрузить разумеется, можно, только обмен электронами будет на поверхности цинка, а не через внешнюю цепь. Цинк начнет растворятся постепенно покрываясь ямками, в тоже время покрываясь корочкой меди, которая сформирует губчатое коричневое покрытие. Но солевой мостик создает сопротивление диффузии ионов, создавая электрическое сопротивление, мешающее получению сильного тока от элемента, поэтому наилучшее устройство элемента, при условии его неподвижности, основывается на гравитационном разделении растворов без какой-либо перегородки между ними. В таком элементе разбавленный раствор ZnSO4 осторожно заливают поверх концентрированного, более плотного раствора CuSO4. При неподвижном состоянии и отсутствии вибраций элемент работает очень хорошо. Внутреннее сопротивление таком элементе почти полностью отсутствует, и это дает возможность получать большие токи. Такой элемент Даниэля раньше широко использовался в качестве стационарного источника тока на телеграфных станциях и в домах для дверных звонков. Подобный элемент можно сделать и другим способом. Стеклянная банка заливается концентрированным растворов поваренной соли (NaCl). У дна банки размещается медный электрод, а наверху цинковый. На дно банки аккуратно опускаются кристаллы CuSO4. Сульфат меди, растворяясь на дне, с концентрированным раствором NaCl смешивается медленно, из-за этого ионы Cu2+ не достигают цинкового электрода.
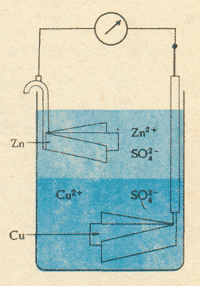
Медно-цинковый гальванический элемент в одной банке без перегородок
Как мы видим, для того, чтобы электроны могли совершить полезную работу, нужно заставить их двигаться по внешней цепи.
В принципе, любой окислительно-восстановительный процесс может дать свой гальванический элемент. Ведь каждая пара характеризуется своим окислительно-восстановительным потенциалом. Выбираем две такие пары, располагаем их как электроды, соединяем соответствующим образом и элемент готов. Он будет работать. Есть только одна трудность - как сделать электрод. С металлами это не сложно. Погружаем их в раствор их же соли, и электрод сконструирован. С некоторыми газами это также оказывается делом возможным. Но существует много других окислительно-восстановительных процессов, при которых конструирование соответствующих электродов совсем не просто.
Не знаю, обратили ли Вы достаточное внимание на то обстоятельство, что электродный потенциал (по уравнениям Нернста и Петерса) в немалой степени зависит от концентрации ионов в растворе. Не можем ли мы и из этого извлечь пользу? Раз электродный потенциал зависит от концентрации, то при погружении одного и того же металла в растворы его ионов различной концентрации можно получать различный электродный потенциал. Из таких электродов можно сделать и гальванический элемент. Называют его концентрационный гальванический элемент. Берем, например, две медные пластинки и погружаем их в растворы с концентрацией медных солей соответственно 2 моль/л и 0,2 моль/л (в расчете на ион меди). Ставим электролитный мост. Соединяем электроды проводником. Элемент начинает работать. На одном электроде, там, где концентрация ионов меди в растворе ниже, происходит непрерывное растворение меди:
Cu - 2е- > Cu2+
При этом медь окисляется, концентрация ионов меди в растворе постоянно повышается. На другом электроде совершается обратный переход - ионы меди из раствора осаждаются на поверхность металла:
Cu2+ + 2е- > Cu
Ионы меди восстанавливаются, их концентрация в растворе непрерывно уменьшается. Итак, концентрационный гальванический элемент работает за счет разности концентрации ионов меди у обоих электродов, пока концентрации ионов у двух электродов не станут равными. Тогда исчезнет и разность электродных потенциалов, следовательно, не будет и напряжения. Можно добавить к одному из двух растворов воду, чтобы изменилась концентрация соли. Опять возникнет разность электродных потенциалов, и гальванический элемент снова заработает. Можно даже поменять знаки у электродов. Концентрационные гальванические элементы редко используются на практике, поскольку при их изготовлении как из различных, так и одинаковых окислительно-восстановительных пар (при различной концентрации соответствующих ионов в растворе), трудно учесть влияние, зависящего от концентрации, слагаемого в уравнении Нернста.
Вопрос, почему растворы электролитов проводят электрический ток, волновал еще и Гальвани, и Фарадея, и многих других ученых. Вскоре после открытия вольтова столба В. Никольсон и А. Карлейль опубликовали результаты своих исследований (2 мая 1800 г.). Они работали с вольтовым столбом, составленным из семнадцати серебряных монет, такого же количества цинковых пластинок и пропитанных соленой водой картонных кружков. К самой нижней серебряной монете был прикреплен медный проводник. Другой его конец погрузили в каплю воды, которая находилась на картонном кружке, лежащем на верхней цинковой пластинке. Результат был удивительный: около проводника выделился водород. Никольсон и Карлейль усовершенствовали аппаратуру, повторили свои опыты и получили тот же самый результат. Они установили, что под влиянием электрического тока на одном электроде из воды выделяется водород, а на другом - кислород. Только одно оставалось непонятным: почему водород и кислород выделяются в разных местах и притом на значительном расстоянии один от другого. Ведь было известно, что они входили в состав молекулы воды. Впервые ученые обратили внимание на химические изменения, которые происходят с водой под действием электрического тока. Было ясно, что вода разлагается. Но каков механизм этого процесса? - вопрос, который десятилетия подряд вопреки многочисленным усилиям не находил правильного ответа. Некоторые считали, что пока кислород выделяется на поверхности цинка (положительный электрод), водород незаметно проникает через жидкость к серебряному электроду (отрицательный электрод). Были и совсем фантастические представления. По мнению итальянца Брунателли, например, электрический ток отождествляется с особенной кислотой, называемой "электрической". Он писал: "Если электрическую кислоту заставить течь, она сама растворяет металлы по тому же принципу, что и вода растворяет соль, и при этом обладает свойством относить растворенные металлы на очень большое расстояние".
Первое удачное объяснение механизма протекания тока через электролиты принадлежит К. Гротгусу "Мои наблюдения над действием вольтова столба, - писал он,- натолкнули меня на мысль, что аналогичная полярность (в вольтовом столбе одна пластинка заряжается положительно, а другая - отрицательно) может иметь место и у молекул воды, если на них действует подобный электрический агент. И я должен признаться - для меня это был луч света". По мнению Гротгуса, компоненты воды - это частицы, несущие электрический заряд: кислород - отрицательный, а водород - положительный. По его теории, длинные цепи последовательно расположенных атомов кислорода и водорода простираются от одного электрода до другого. Крайние атомы этих цепей - на одном конце водород, а на другом кислород, разряжаются на электродах и выделяются в виде свободных газов. Теория Гротгуса выделялась наглядностью, логичностью и простотой. Вот почему она очень быстро приобрела известность и получила всеобщее признание.
Новый большой шаг вперед в объяснении механизма протекания электрического тока через электролиты сделал в первой четверти XIX века шведский химик Й. Берцелиус. Из того факта, что под действием электрического тока соли разлагаются на компоненты, которые выделяются на двух различных электродах, он делает вывод, что сложное вещество всегда состоит из двух частей - одна заряжена положительно, а другая - отрицательно. Берцелиус разделяет все "тела" на два класса - с положительным электрическим зарядом и с отрицательным. При химическом взаимодействии "тел" происходит нейтрализация противоположных зарядов. Так рождается электрохимическая теория Берцелиуса в учении о химической связи. Простота теории, а также большой авторитет ее создателя определяют ее широкое применение при объяснении химических процессов, несмотря на то, что данные экспериментов очень часто не согласуются с теоретическими постулатами.
В начале XIX века свой вклад в электрохимию вносит и Фарадей. По мнению Фарадея, электролиты - это вещества, которые в водном растворе распадаются на положительные и отрицательные ионы (катионы и анионы). Фарадей считал, что такой распад возможен только под влиянием электрического тока.
Усилия многих ученых были направлены на изучение электропроводимости растворов. Еще Вольта, исходя из свойства растворов проводить электрический ток, назвал их проводниками второго рода (проводниками первого рода называют металлы). Русский физик А. Савельев в 1853 г. установил существование зависимости электропроводимости раствора от температуры и концентрации электролита. Он определил, что, в отличие от металлов, в растворах электролитов с повышением температуры растет электропроводимость. Немецкий химик и физик В. Гитторф всесторонне исследовал движение ионов в растворах электролитов. Гитторф экспериментально доказал, что при протекании электрического тока в растворах электролитов катионы движутся к катоду, а анионы к аноду. Он установил, что ионы перемещаются с разными скоростями. Впервые в его работах была высказана мысль, что "появление ионов не есть результат действия электрического тока" и что "ионы электролита слабо соединены в молекулах". Идеи Гитторфа были очень смелыми и не поддерживали общепринятых в то время представлений, ведь даже такие выдающиеся ученые как Дэви, Де ла Гив, Фарадей считали, что разложение электролита на ионы происходит только под действием электрического тока.
В 1857 г. в сочинении "О прохождении электричества через электролиты" Р. Клаузиус рассматривает эту проблему по-новому. По мнению Клаузиуса, при тепловом движении между молекулами происходят столкновения, в результате которых молекулы распадаются на ионы, эти ионы в течение некоторого времени существуют самостоятельно, а затем вновь соединяются в молекулы. С увеличением температуры повышается скорость движения молекул, увеличивается число столкновений, количество ионов повышается, а следовательно увеличивается электропроводимость раствора. Теорию Клаузиуса ученые признали быстро, но существовали расхождения с экспериментальным результатами. Она не могла разъяснить, почему легче всего распадаются на ионы молекулы тех соединений, которые, как тогда считалось, состоят из элементов с наибольшим сродством друг к другу. Ведь при соединении этих элементов в вещества выделяется наибольшее количество теплоты и связи должны быть самыми прочными. Поскольку на этот вопрос теория Клаузиуса не могла дать ответа, очень скоро она была забыта. Для интерпретации результатов своих экспериментов электрохимики все еще предпочитали использовать теорию Гротгуса.
Исследования криоскопических, эбулиоскопических и осмотических явлений дали химикам много ценной информации. Однако в ряде случаев получались странные результаты, которые не укладывались ни в какие теории. Получалось, например, что в разбавленных растворах поваренной соли число "молекул" вдвое больше, чем вычисленное по формуле NaCl, в растворах CaCl2 - втрое больше и т.д. Можно было бы предположить, что указанные вещества при растворении в воде распадаются на несколько частей - как говорят химики, претерпевают диссоциацию (от лат. dissociation - "разъединение", "разделение"). Такие явления тогда были известны: в частности, при нагревании хлорида аммония он возгоняется с одновременной диссоциацией на две молекулы: NH4Cl > NH3 + HCl. Но распад при нагревании объяснить намного проще: энергия, необходимая для диссоциации, черпается за счёт тепловой энергии. А вот откуда берётся энергия, когда соль растворяется в воде при комнатной температуре, никто объяснить не мог. Температура раствора часто почти не меняется. Более того, при растворении некоторых солей в воде раствор сильно нагревается.
В 1887 г. Аррениус, исследуя электропроводность водных растворов, в своей работе "О диссоциации растворенных в воде веществ", высказал предположение, что некоторые вещества в растворах находятся в виде заряженных частиц - ионов, независимо от того, пропускается через раствор электрический ток или нет. Эта гипотеза объясняла, с одной стороны, почему растворы определённых веществ (электролитов) проводят ток, с другой - увеличение количества частиц в растворе. Измерения показали также, что полный распад на ионы происходит только в очень разбавленных растворах. В более концентрированных электролиты вели себя так, как будто они распадаются на ионы только частично. Однако большинство учёных идею о диссоциации в растворах не приняли. Ведь в конце XIX в. ещё не было ясного понимания, чем ионы отличаются от нейтральных атомов. Казалось невероятным, что, например, хлорид натрия в воде может существовать в виде отдельных ионов натрия и хлора: как известно, натрий бурно реагирует с водой, а раствор хлора имеет жёлто-зелёный цвет и ядовит. Неудивительно, что Аррениус, изложивший свои взгляды в диссертации, получил на неё плохие отзывы. К числу самых непримиримых противников Аррениуса принадлежал Д. И. Менделеев, сформировавший "химическую" теорию растворов - в отличие от "физической" теории Аррениуса. Менделеев считал, что в растворах происходят, по сути, химические взаимодействия между растворённым веществом и растворителем, тогда как по теории Аррениуса водные растворы представляли собой механическую смесь ионов и воды. В 1889 г. Менделеев опубликовал в "Журнале Русского физико-химического общества" "Заметку о диссоциации растворённых веществ", в которой поставил под сомнение сам факт существования ионов в растворах электролитов. "Сохраняя всё то, что приобретено в отношении к пониманию растворов, - писал он, - мне кажется, можно оставить в стороне гипотезу об особом виде диссоциации - на ионы, совершающейся с электролитами при образовании слабых растворов". Хотя Менделеев, критикуя теорию Аррениуса, во многом оказался не прав, в его рассуждениях всё же была доля истины: растворённые вещества действительно часто взаимодействуют с растворителем. Спор между сторонниками и противниками Аррениуса длился не один год. И, как это часто бывает в науке, в ожесточённом споре между приверженцами физической и химической теории правы оказались обе стороны. Очень сильное химическое взаимодействие между ионами и молекулами растворителя даёт ту энергию, которая нужна для разрушения кристаллической решётки веществ-электролитов, например поваренной соли. В случае водных растворов эта энергия называется энергией гидратации, и эта энергия может иметь колоссальные значения. Так, энергия гидратации ионов Cl- равна 352 кДж/моль, ионов Na+ - 423 кДж/моль, ионов Н+ - 1109 кДж/моль, ионов Ca2+ - 1615 кДж/моль. Для сравнения: чтобы разорвать связь между атомами в молекуле хлора, требуется всего 242 кДж/моль. Чтобы разъединить катионы и анионы в кристаллах электролитов, тоже требуется затратить немало энергии (она называется энергией кристаллической решётки) - 788 кДж/моль для NaCl, 1044 кДж/моль для LiF, 2240 кДж/моль для CaCl2 и т. д. Если суммарная энергия гидратации катионов и анионов при образовании раствора больше энергии кристаллической решётки, то растворение будет сопровождаться нагреванием, а если меньше - охлаждением раствора. Именно поэтому при растворении в воде таких веществ, как LiCl, безводный CaCl2, и многих других раствор нагревается, а при растворении NH4NO3, KNO3, KCl, и некоторых других - охлаждается. Охлаждение может быть таким сильным, что стакан, в котором готовят раствор, снаружи покрывается росой или даже примерзает к мокрому столу.
Большая часть электролитов - соли, т. е. кристаллические вещества. В узлах этих кристаллических решеток располагаются положительные и отрицательные ионы (значит, молекула уже диссоциирована), и эти ионы совершают колебательные движения около положения равновесия. Примером такого соединения является хлорид натрия NaCl. Процесс растворения начинается при соприкосновении молекул воды с поверхностью кристалла, т. е. на границе раздела твердого тела (NaCl) и жидкости (H2O). Молекулы H2O приближаются к ионам Na+ и Cl-, расположенным в узлах поверхностного слоя кристаллической решетки, при этом они ориентируются атомом кислорода к иону натрия, а одним из атомов водорода к ионам хлора, происходит взаимодействие ионов Na+ и Cl- с молекулами воды, ионы отрываются от кристалла (решетка разрушается), переходят в жидкость (в воду); с этого момента жидкость состоит уже не только из молекул H2O, но и ионов Na+ и Cl- - так образуется водный раствор хлорида натрия. Процесс растворения закончится, когда молекулы воды полностью разрушат решетку кристалла. Когда ион отрывается от поверхности кристалла, его немедленно окружают молекулы воды, ион гидратируется, причем молекулы воды, которые ближе всех к иону, ведут себя иначе, чем те, что находятся в отдалении. Ведь ионы обладают электрическим зарядом, и молекулы воды, попадая в электрическое поле заряженного иона, испытывают воздействие с его стороны. Для разных ионов число таких молекул воды будет разным, оно зависит от размера иона и его заряда. Эти молекулы воды образуют гидратную оболочку иона в растворе.
Как ток проходит через раствор? Ведь электрический ток представляет собой целенаправленное движение электронов по замкнутому контуру, а в растворе нет свободных электронов. Электроны проходят только по внешней, металлической, цепи. В растворе есть другие носители электрических зарядов - это ионы. Попробуем объяснить их поведение с помощью представлений теории сильных электролитов, известной под названием теории Дебая и Хюккеля. В растворе каждый положительный ион кроме гидратной оболочки окружен ещё несколькими отрицательными ионами с такой же оболочкой и, наоборот, у каждого отрицательного иона есть оболочка из положительных ионов. При включении источника постоянного напряжения, раствор "оживает": катион направляется к катоду, но его продвижение затруднено, потому что анионы вместе со своими гидратными оболочками движутся в противоположном направлении и тормозят перемещение положительно заряженного иона. Точно так же направленному движению анионов к аноду мешают гидратированные катионы. Перемещение ионов в концентрированных растворах происходит очень трудно: при своем движении они встречают большое сопротивление со стороны ионов с зарядом противоположного знака. По этой причине в концентрированных растворах электропроводимость раствора будет меньше по сравнению с разбавленными растворами, где ионы движутся свободнее. Итак, хотя ионов в концентрированных растворах много, в действительности не все они активно участвуют в получении электрического тока. При столкновениях часть ионов соединяется в молекулы, которые через некоторое время опять распадаются, т. е. эффективная, активная концентрация электролита будет меньше истинной концентрации соли в воде. Таким образом, число ионов, способных переносить электричество, всегда меньше числа ионов реально присутствующих в растворе и соответствующих данной концентрации электролита. В этом случае принято говорить не о концентрации ионов электролита в воде, а об их активности. Понятие активности ионов ввели в теорию растворов П. Дебай и В. Хюккель.
Не подумайте, что сильные электролиты - только соли, при растворении которых все молекулы диссоциируют на ионы. Диссоциация характерна и для веществ, с полярными молекулами. Когда вещество состоящей из полярных молекул попадает в воду, процесс протекает примерно также как с кристаллической решеткой соли, молекулы воды располагаются у противоположных полюсов диполей молекулярной кристаллической решетки, молекулы вещества деформируются, расстояние между их противоположно заряженными полюсами увеличивается, в результате химическая связь между отдельными частями молекулы ослабевает. Если воздействие молекул воды на такую дипольную молекулу значительное, то она распадается на положительно и отрицательно заряженные ионы, т. е. раствор становится электропроводящим - в нем появляются носители тока. Например, обладающие дипольным моментом молекулы неорганических кислот сами по себе не могут проводить электрический ток. Но при растворении такой "абсолютно сухой" кислоты в воде, молекулы H2O способствуют диссоциации молекул H2SO4, HCl, HNO3 и других на положительно заряженные ионы Н+ и отрицательно заряженные анионы SO42-, Cl-, NO3-. Но полная диссоциация дипольных молекул характерна только для сильных электролитов и в разбавленных растворах. У более слабых полярных молекул имеет место неполная диссоциация.
А если растворителем будет другая жидкость? Например, газ хлороводород растворяется в воде и образуется сильная соляная кислота. В спирте, однако, хлороводород почти не диссоциирует. В чем разница? Что определяет свойства воды как растворителя электролитов? Прежде всего, это полярный характер молекул воды. Кроме того, у воды большая диэлектрическая постоянная ?. ? - это характерная для данной среды величина, которая показывает, во сколько раз сила взаимодействия двух единичных зарядов на расстоянии, равном единице, в данной среде меньше такой же силы в вакууме. Она фигурирует в законе Кулона. Другими словами, чем больше значение ?, тем слабее взаимодействие между двумя разноименными зарядами, попавшими в данную среду. Но ведь в кристаллических решетках ионы соединяются между собой именно под действием электростатических сил. В каждой среде с большой диэлектрической константой силы притяжения между ионами невелики и электролитическая диссоциация будет происходить легче. Существуют и другие растворители, которые способствуют электролитической диссоциации. Полярные молекулы этих растворителей должны иметь большие диэлектрические постоянные. Поэтому электролитическая диссоциация происходит и в среде жидкого аммиака, и в жидком диоксиде серы, и в сильных неорганических кислотах. Главное - во взаимодействии между растворенным веществом и растворителем. Растворение и электролитическая диссоциация по существу представляют собой не физический процесс (как, например, механический процесс дробления), а сложное физико-химическое взаимодействие. Итак, электрический ток переносят в растворах электролитов ионы. При этом электрическая энергия превращается в энергию химического процесса.
Кольрауш и не предполагал, что натолкнется на эту особенность системы раствор-электрод. Методично измеряя электропроводность растворов, он в 1878 г. обнаружил, что граница между электродом и раствором ведет себя по отношению к переменному току, как электрический конденсатор большой емкости. Это было удивительно. Чтобы как-то объяснить это, Кольрауш предположил, что при пропускании переменного тока на электроде создастся не видимая глазом газовая пленка из выделяющегося кислорода и водорода. И ведет она себя как некий изолятор, разделяющий заряды электрода и заряды ионов раствора. В итоге образуется конденсатор большой емкости.
С тех пор граница электрод-раствор притягивала к себе пристальное внимание исследователей: ведь именно в этой зоне происходили все события, связывающие между собой химические и электрические явления. В этом тончайшем загадочном слое протекали основные процессы, которые приводят к электрохимическим реакциям: при наложении тока - к электролизу, а при соответствующем выборе электродов и электролита - наоборот, к выработке тока. Через некоторое время выяснилось, что никакой изолирующей газовой пленки на электродах нет. Это еще больше усилило интерес к этой границе.
Еще в 50-х годах XIX века Георг Квинке для объяснения механизма только что открытого им так называемого потенциала протекания высказал гипотезу двойного слоя. Она оказалась весьма плодотворной в различных областях знаний. В 1881 г. Гельмгольц, изучая поляризацию, то есть сдвиг потенциала электрода под действием тока, предположил, что на границе электрод - раствор создастся двойной электрический слой (ДЭС) зарядов: один - на металле, другой в виде ионов - у поверхности электрода.
Механизм образования этого слоя таков. При погружении металла в раствор его соли в зависимости от концентрации раствора одинаково вероятен как переход ионов металла из кристаллической решетки металла в раствор, так и обратный процесс. И в том и в другом случае на электроде создастся либо избыток, либо недостаток электронов. В связи с этим к электроду притягиваются те или иные ионы. Так на границе электрода с раствором образуются два слоя противоположных зарядов: один на самом электроде, другой в растворе, в непосредственной близости от электрода. Заряд на электроде может возникать и за счет внешнего источника тока. Тогда на одном электроде образуется избыток отрицательных зарядов, и около него сосредотачиваются катионы раствора, а на другом электроде - избыток положительных зарядов, и около него сосредотачиваются анионы. В любом случае на границе между электродом и раствором всегда образуется двойной электрический слой. Ионы, однако, обладают вполне определенным радиусом, а раз так, то их электрические центры могут подойти к поверхности электрода только на расстояние этого радиуса, от которого и зависит толщина слоя (называют его плотным слоем, а его границу в честь автора первой теории двойного электрического слоя - плоскостью Гельмгольца). Образовавшийся плоский конденсатор необычен. Расстояние между его "обкладками" равно радиусу ионов, то есть стомиллионным долям сантиметра. Если разность потенциалов равна одному вольту, то напряженность электрического тока достигает при этом миллиона вольт на сантиметр. Это очень высокая напряженность. Даже в мощных электростатических ускорителях заряженных частиц она гораздо меньше. Естественно предположить, что при такой высокой напряженности электрического поля реакционная способность веществ меняется, изменяются вообще химические свойства вещества. На катоде такие поля способны извлечь электроны из металлов и вызвать нейтрализацию катионов. А на аноде они обусловливают начальный акт растворения - переход металла из кристаллической решетки в двойной слой в виде ионов.
В природе не существует абсолютно простых, элементарных объектов, у каждого бесконечное множество различных свойств, сложная внутренняя структура. На каждом новом этапе исследования наши представления о структуре любого объекта могут сильно отличаться от тех, которые были известны раньше. То же произошло и с представлениями о двойном электрическом слое. Впрочем, едва только появилась первая теория этого слоя, как многих начал беспокоить вопрос, почему ионы, так близко подойдя к электроду, не разряжаются на нем. Что удерживает их от разряда? На этот вопрос дал ответ ученик и сотрудник А.Г. Столетова, профессор Казанского университета Роберт Андреевич Колли (1845-1891). В своей докторской диссертации "О поляризации в электролитах" (1878) он показал, что находящиеся в двойном слое ионы удерживаются от разряда благодаря взаимодействию с растворителем. Это утверждение оказалось вполне справедливым.
В 1905 г. французский физик Луи Гюи (1854-1926), установивший тепловую природу броуновского движения, указал, что принятое в модели Гельмгольца строго фиксированное расположение ионов в двойном слое в реальности невозможно, так как, кроме электростатических, на ионы действуют силы, обусловленные тепловым движением молекул. Это означало, что концентрация ионов около границы раздела фаз постоянно убывает в направлении, перпендикулярном поверхности раздела. Новая модель двойного слоя получила название диффузного двойного слоя Гюи-Чапмена. Во многом она была подобна модели, которую Дебай и Хюккель создали позже для описания ионной атмосферы вокруг заряженной частицы.
Наконец, в 1924 г. Отто Штерн (1888-1969), профессор Гамбургского университета и впоследствии Нобелевский лауреат, предложил учитывать специфическую адсорбцию ионов, то есть адсорбцию, происходящую под влиянием химических сил. В своей модели двойного слоя он объединил модели Гельмгольца и Гюи-Чапмена. Модель Штерна объясняла явления перезарядки поверхности в электрокинетических измерениях и очень хорошо согласовывалась с экспериментальными данными. Но в теории Штерна не учитывалось взаимодействие частиц, образующих двойной слой. Кроме того, она отождествляла локализацию специфически адсорбированных ионов с плоскостью диффузного слоя. Эти недостатки устранил в 40-х годах XX века американский ученый Дональд Грэм. Он предположил, что существуют две плоскости Гельмгольца: одна, внутренняя, плоскость электрических центров специфически адсорбированных ионов или молекул растворителя и другая, внешняя, плоскость центров неорганических катионов, которые специфически не адсорбируются. Таким образом, в пространстве между поверхностью металла или твердого тела и раствором имеются как бы три последовательно соединенных конденсатора: электростатическая емкость пространства между металлом и внутренней плоскостью Гельмгольца, электростатическая емкость пространства между двумя плоскостями Гельмгольца и емкость диффузного слоя.
Как же выглядит после всех уточнений граница разделения металл-раствор? Слой, непосредственно примыкающий к металлу, состоит из молекул воды либо другого растворителя, диполи которых ориентированы к поверхности металлического электрода. Здесь или очень близко отсюда находятся и ионы (скорее всего катионы), слабо гидратированные либо склонные к сильной адсорбции на металле. Это плотная часть двойного слоя. Сильно же гидратированные ионы не могут подойти к поверхности металла так близко и располагаются за внешней плоскостью Гельмгольца, от которой в объем раствора простирается диффузная часть слоя. При больших концентрациях электролита концентрация адсорбированных ионов возрастает и диффузная часть слоя сжимается. Свойства границы раздела фаз приближаются тогда к свойствам двойного слоя Гельмгольца. При очень низких концентрациях электролита диффузная часть слоя начинает играть все более важную роль.
Диффузная область двойного слоя существует не только в растворе. Как это ни странно, но такая же область появляется и в полупроводниковом электроде, для которого характерна умеренная диэлектрическая проницаемость и низкая концентрация носителей заряда в отличие от металла, где концентрация носителей заряда высока и на поверхности образуется плотный слой. Двойной электрический слой мы обнаруживаем и на границе раздела электролит-изолятор, если на изоляторе есть фиксированный заряд, который может создаться за счет адсорбции ионов, ионного обмена между материалом и раствором и так далее. В сущности, он существует везде, где есть поверхность, образованная химическими разнородными материалами, и возможен переход зарядов через границу раздела, существует и оказывает сильное влияние на все - на подвижность заряженных коллоидных частиц, на течение жидкости в пористом материале, на свойства пористых и других мембранных систем.
Открытый еще в 1807 г. профессором Рейссом электрофорез - движение коллоидных частиц в растворе под влиянием электрического тока, а также другие электрокинетические явления послужили основой для создания методов изучения двойного электрического слоя. При относительном движении твердого тела в жидкости ионы диффузной обкладки двойного электрического слоя увлекаются движущейся жидкостью, что позволяет экспериментально определить локализованный в диффузной части двойного слоя скачок потенциала, считающийся одной из важнейших его характеристик.
Французский физик Габриэль Липпман (1845-1921), создатель цветной фотографии, изучал в 1875 г. связь между величиной поверхностного натяжения находящейся в разбавленной серной кислоте ртути и разностью потенциалов, образующейся в месте соприкосновения ртути и кислоты. Он определил, что поверхностное натяжение ртути в месте соприкосновения ее с электролитом является функцией электродвижущей силы поляризации. После работ Липпмана многие ученые начали серьезно исследовать, как под действием электрического тока меняется форма ртутных электродов. Были разработаны специальные приборы - капиллярные электрометры. Оказалось, что зависимость поверхностного натяжения ртути от приложенного потенциала представляет собой в первом приближении перевернутую параболу. В 1919 г. А.Н. Фрумкин доказал, что форма электрокапиллярной кривой зависит от состава раствора: адсорбция ионов меняет поверхностное натяжение ртути. Фрумкин вывел и экспериментально проверил основное уравнение электрокапиллярности. Используя это уравнение и измеряя пограничное натяжение, можно рассчитать заряд электрода, емкость двойного электрического слоя, потенциал, при котором заряд электрода равен нулю, а также адсорбцию различных компонентов раствора на поверхности электрода. Одним словом, узнать о двойном слое практически все. После этой работы Фрумкина, продемонстрировавшего, что исследование электрокапиллярных явлений дает ценнейшие сведения о строении двойного слоя, его стали изучать на ртутном и на галлиевом электродах, на электродах из амальгам таллия и индия и из других металлов. Был открыт ряд интересных явлений, сопутствующих электролизу, например, конкурирующий характер адсорбции из растворов, связанный с вытеснением молекул растворителя, адсорбированных ранее на электроде. Сам же Фрумкин определил, что строение двойного слоя у целых групп металлов имеет в основном сходные черты, а это, в свою очередь, означает, что результаты, полученные на жидких металлах, наиболее удобных в экспериментальном отношении, имеют общее значение. Фрумкин ввел в науку понятие о потенциале нулевого заряда. На электрокапиллярных кривых потенциал нулевого заряда соответствует максимуму кривой. Это понятие явилось как бы оценочным критерием поведения электрода, раскрыло его адсорбционную и кинетическую сущность. Таким образом, самым примечательным в изучении этого необычайно сложного двойного слоя оказалось то, что наблюдения за изменением потенциала в нем стали чрезвычайно важными при определении скорости электродных процессов.
Железо ржавеет. Из-за различного физико-химического воздействия внешней среды подвержены коррозии и другие металлы. Ежегодно от коррозии теряется около трети годового производства металла. Потери исчисляются десятками миллиардов долларов, марок, рублей. И беда не только в том, что просто разрушается металл, - нет, разрушаются конструкции, на которые был тоже затрачен труд, ржавеют мосты, машины, крыши, памятники.
Противостоять коррозии непросто. С точки зрения химии, это процесс окисления, в котором принимает участие электрон. Не имеет значения, превратится ли при этом металл в оксид, карбонат, гидроксид или сульфид. Важно, что он отдает свои электроны, окисляется. Очень часто электроны достаются кислороду воздуха, а продуктом коррозии является оксид. Если в коррозии участвует еще и атмосферная влага, может образоваться и гидроксид. Так кислород воздуха совместно с влагой разъедают железо, при этом образуется ржавчина, которую можно представить как Fe2O3•xH2O. В окислении меди участвует диоксид углерода, окружающего воздуха. Подвергшаяся коррозии медь покрывается красивой по цвету патиной - основным карбонатом меди. Серебро на воздухе чернеет - это на его поверхности при участии содержащихся в воздухе соединений серы образуется сульфид серебра. Во всех этих процессах виновник известен. Соответствующий процесс можно записать химическим уравнением. Поэтому такие случаи мы относим к химической коррозии. Название другого типа коррозии - электрохимическая коррозия - можно считать условным. И в этом случаи происходит химический процесс, но по правилам электрохимии - с образованием гальванического элемента.
Имеются примеры поразительной стойкости некоторых металлических сооружений. Существует железная колонна во дворе минарета Кутуб-Минар в Дели. Она стоит уже тысячу лет, и хоть бы что. Говорят, один иностранец решил раскрыть тайну этого нержавеющего железа и каким-то образом отколол небольшой кусочек от колонны. Каково же было его удивление и разочарование, когда еще на корабле по пути из Индии он заметил, что металл покрылся ржавчиной. В конце концов ученые предположили, что стойкость индийского железа объясняется присутствием в атмосфере Дели большого количества аммиака и тем, что в металле отсутствует сера - результат выплавки железа на древесном, а не на каменном угле (в древесном серы нет). К сожалению, такие стойкие конструкции, как эта колонна, на Земле большая редкость.
Существенные успехи в борьбе с коррозией появились лишь после того, как было установлено, что коррозия во многом имеет электрохимический характер. Большую роль в понимании механизма коррозии сыграли исследования академика В.А. Кистяковского, члена-корреспондента АН СССР Н.А. Изгарышева (1884-1956) и члена-корреспондента АН СССР Г.В. Акимова (1901-1953). Георгию Владимировичу Акимову мы также обязаны созданием первой в СССР научной коррозионной лаборатории и первой в мире кафедры коррозии, организованной в 1931 г. в Московском институте цветных металлов. Электрохимическая теория коррозии, справедливо отмечал академик Я.М. Колотыркин, "указала путь не только к оценке химического сопротивления металлов и сплавов, но и к повышению их стойкости за счет направленного легирования самого металла, модифицирования агрессивной среды и регулирования потенциала".
Металлы высокой степени чистоты не подвергаются электрохимической коррозии. Ну, а если они содержат примеси, тогда другое дело: оба металла связаны "коротко", не хватает только электролита, чтобы получился гальванический элемент. А электролит найти легко - хотя бы влага, содержащаяся в атмосфере. Мы знаем, что примесей мало и на поверхности металла они сгруппированы на отдельных маленьких участках. Здесь появится множество микроскопических гальванических элементов. Возникнет, и начнет работать. Труднее всего придется самому неблагородному металлу - тому, который имеет более отрицательный электродный потенциал, короче говоря, основному металлу. Вот почему особенно опасны примеси, которые стоят ближе к концу в ряду относительной активности металлов. Важно остерегаться именно примесей благородных металлов. Но даже если металл не содержит опасных примесей, разность потенциала создается и участками из одного металла, но по-разному обработанных (металл, подвергнутый, например, механической обработке, и металл после обжига образуют гальваническую пару), и наличием узких зазоров и тонких неэлектропроводных пленок, даже различной аэрацией среды, и коррозия начинает разъедать металл. С увеличением глубины концентрация кислорода в воде уменьшается. Это значит, что на определенной глубине на опущенном в воду металле, допустим, на обшивке корпуса корабля, будет достигнут равновесный потенциал реакции восстановления кислорода. Поверхность, находящаяся ближе к ватерлинии, поведет себя в этом случае как катод, а находящаяся глубже - как анод. На аноде же металл и начнет разрушаться. А если на поверхность металла попадает капля воды, в центре капли, где кислорода мало, металл становится анодом и растворяется, а роль катода начинают выполнять края капли, более доступные влиянию кислорода. На краях будет осаждаться гидроокись металла. Очень опасна межкристаллитная коррозия, она идет вдоль сварных швов. Коррозию увеличивают механическая нагрузка, трение, высокие скорости потока. В борьбе с коррозией ученые и инженеры применяют более стойкие материалы: алюминий, титан, различные сплавы. Алюминий, находясь значительно левее железа в ряду активности металлов, не подвержен значительной коррозии благодаря тому, что на поверхности алюминия образуется тонкий слой окисла, предохраняющий расположенный под ним металл от дальнейшей коррозии. Магний тоже защищен от коррозии пленкой окисла. Хорошая защитная пленка образуется на поверхности сплавов железа с хромом. Эти сплавы и есть всем известная нержавеющая сталь.
Самый простой способ защиты от коррозии - это изолировать металл от окружающей среды. Достаточно поместить металлическую деталь в инертную атмосферу или изолировать в вакууме - и все. Она сохранится. Только для чего нам такие "консервированные" деталей? Нужно, чтобы они работали. Тогда изолируем их другим способом - покроем смазкой, лаком, асфальтом, краской. Это дешево и легко выполнимо. Но иногда этот метод нельзя использовать, так как части трутся друг о друга, окраска стирается или обкалывается, или же мы хотим, чтобы деталь была блестящей и чистой. Представьте, к примеру, как бы мы пользовались крашеными и лакированными вилками и ножами. Поэтому для защиты металла от коррозии часто требуется другой металл. Он должен быть устойчив к действию окружающей среды, по возможности иметь привлекательный внешний вид, быть дешевым и доступным. Не советовал бы Вам, например, золотить железное изделие, даже если бы золото стало самым распространенным, дешевым и доступным металлом. Оно окажет плохую услугу нашей железке. Золото стоит значительно дальше железа в ряду относительной активности металлов, и при малейшей царапине на покрытии на этом месте появится гальванический элемент - коррозия начнет свою разрушительную работу. На поверхности золота будет выделяться водород, а железо вскоре превратится в кучу ржавчины, покрытую золотой пленкой. Нет, ни в коем случае материал покрытия не должен подбираться из тех металлов, которые расположены за основным металлом в ряду относительной активности! На практике чаще всего железо покрывают цинком. Цинк доступен и недорог, сравнительно устойчив к действию окружающей среды, а самое важное - стоит впереди железа в ряду относительной активности. Если цинковое покрытие разрушается, образуется гальваническая пара: цинк становится анодом, железо - катодом, и тогда коррозионному воздействию подвергается цинк, а на железе идут восстановительные процессы, и его коррозия начинается лишь после того, как прокорродирует весь цинк. Использование олова, например, для покрытия консервных банок, связано с хорошими свойствами самого покрытия, а когда такая банка оказывается на помойке коррозия основного металла (железа) протекает очень активно.
Схема коррозии оцинкованного железа
Схема коррозии белой жести
Если хочется иметь и позолоченные, и посеребренные предметы или хотя бы покрывать железо никелем - металлом, стоящим позади него в ряду активности. Они и устойчивы, и тверды, и красивы. Например, можно железный предмет покрыть медью. Сделать это нетрудно, но покрытие не будет устойчивым. Теперь нанесем на него слой никеля - и никакое повреждение покрытию не страшно. Пусть даже возникнет элемент между никелевым и медным электродами. На каком-то участке никель разрушится, а на меди выделится водород. А железо в буквальном смысле "останется в стороне от схватки" металлов с коррозией. Так работают многослойные покрытия. И совсем не нужны толстые слои, даже наоборот, они должны быть тонкими. Они выполняют роль, которую предопределили им электродные потенциалы.
Возможен и другой вариант, в основе которого также лежит ряд активности, - это протекторная защита (протектор (от латинского protectio - прикрытие) - покровитель, защитник). Представьте себе огромный корабль, который плывет по океану. Его стальной корпус вспарывает воды, а ниже ватерлинии коррозия не прекращает своей разрушительной работы. Может быть, днище покрасить? Или нанести многослойное металлическое покрытие? Можно поступить иначе. К корпусу крепится кусок менее благородного, чем железо, металла, например цинка. Специально создается гальванический элемент, работающий в этом прекрасном электролите - океанской воде. Цинк растворяется и спустя некоторое время растворится полностью. Тогда мы заменим его новым. Цинк выполнил свою роль - жертвуя собой, защитил стальной корпус корабля. Предполагается, что первым использовал протектороную защиту от коррозии Дэви. Он предложил использовать для защиты медной облицовки кораблей железо. Медь перестала взаимодействовать с морской водой, но так как ионы меди подавляют развитие микроорганизмов и они перестали переходить в воду, корабли стали обрастать ракушками. Это снижало их скоростные характеристики. Можно взять в качестве протектора любой металл, даже сталь - ту же самую, из которой сделан корпус, но на этот раз в цепь включается и источник энергии. Между корпусом и протектором подается напряжение таким образом, чтобы корпус представлял собой катод. Сейчас для нас важен не ряд относительной активности, а только внешнее напряжение. И снова на корпусе будет выделяться водород, а протектор растворится. Такая защита носит название катодной защиты. Очень важно не спутать полюсы источника тока. Если корпус подключить как анод, это не только не помешает коррозии, но, напротив, усилит ее. Весьма эффективны комбинированные методы защиты.
Итак, электрохимия и коррозия тесно связаны между собой. Электрохимия объясняет некоторые коррозионные процессы и учит нас бороться с ними.
Посредством электрических нервных импульсов (потенциалов действия) в живом организме передается информация от рецепторов к нейронам мозга и от нейронов мозга к мышцам. Организм животных является полностью электрифицированной системой.
Животное электричество известно давно. Разряды электрического угря (происходящие при напряжении до 600 В, с током около 60 А и длительностью порядка миллисекунды) использовались медициной еще в Древнем Риме для лечения головной боли, подагры, эпилепсии. Электрический нервный импульс открыл Луиджи Гальвани. Результаты его электрофизиологических опытов изложены в книге "Трактат о силах электричества при мышечном движении" (1791 г.). Гальвани открыл, что мышечные сокращения конечностей препарированной лягушки могут вызваться электрическим импульсом и что сама живая система является источником электрического импульса. Однако огромная популярность идей Гальвани привела к их профанациям, следы которых остались до нашего времени (гальванизация трупов, гальванизм прикосновений и взглядов и т.п.), что вызывало недоверие к экспериментам Гальвани ученых-физиков.
Размышляя о взаимодействии химических и электрических явлений, Фарадей сказал: "Как ни чудесны законы и явления электричества, которые мы наблюдали в мире неорганического вещества и неживой природы, интерес, который они представляют, вряд ли может сравниться с тем, что вызывает та же сила в соединении с нервной системой и жизнью". И в самом деле, ваша рука двигающая мышку, мышцы вашего глаза направили его на эти строки, другие мышцы изменили кривизну хрусталика, чтобы сфокусировать изображение букв на поверхности сетчатки. Все это произошло по приказу нервных импульсов, генерируемых в нервной клетке. Во многих биологических процессах мы при внимательном рассмотрении обнаружим электрохимические звенья.
В XIX веке утвердилось примитивное представление о распространении электрических токов по нервам, как по металлическим проводам. Однако Гельмгольцем (вторая половина XIX века) было показано, что скорость распространения нервного импульса составляет лишь 1-100 м/с, это значительно меньше, чем скорость распространения электрического импульса по проводам до 3 • 108 м/с. Поэтому к концу XIX века гипотеза электрической природы нервного импульса была отвергнута большинством физиологов. Было сделано предположение о распространении по нервным волокнам химической реакции. На самом деле, как было показано позже, медленное распространение электрического нервного импульса связано с медленной перезарядкой конденсаторов, которые представляют собой клеточные мембраны, через большие сопротивления. Постоянная времени перезарядки мембраны ? = RC велика, так как велики емкость мембраны C и сопротивление R нервного волокна.
То, что нервный импульс представляет собой импульс электрического тока, было доказано только к середине XX-го века, в основном в работах английского физиолога А. Ходжкина и его сотрудников. В 1963 году Ходжкину, Хаксли и Иклсу была присуждена Нобелевская премия по медицине "за оперирование нервных клеток".
Еще в середине XIX века была высказана мысль, что поверхность живой клетки имеет общие свойства с электродом в гальванической ячейке. Это оставалось гипотезой до середины 20-х годов XX века, когда стало ясно, что клетки окружены тонкой мембраной весьма сложной структуры. Отдельные части мембраны обладают полупроводниковыми или ионоселективными свойствами - пропускают ионы одного знака или одного элемента (либо натрия, либо калия, например). На такой избирательности основано появление мембранного потенциала, от которого зависит работа информационных и энергопреобразующих систем организма. Мембранный потенциал обеспечивает передачу нервных импульсов, с помощью которых мозг командует работой органов и тканей, а также преобразование химической энергии в механическую. В медицине на исследование электрических полей, созданных биопотенциалами органов и тканей, основаны диагностические методы: электрокардиография, электроэнцефалография, электромиография и другие. Практикуется и лечебное воздействие на ткани и органы внешними электрическими импульсами при электростимуляции. В процессе жизнедеятельности в клетках и тканях могут возникать разности электрических потенциалов:
1) окислительно-восстановительные потенциалы - вследствие переноса электронов от одних молекул к другим;
2) мембранные - вследствие градиента концентрации ионов и переноса ионов через мембрану.
Биопотенциалы, регистрируемые в организме, - это в основном мембранные потенциалы.
Нервная клетка, нейрон, представляет собой звездообразное тело и состоит из тонких отростков - дендритов и аксона - длинного отростка. Конец аксона переходит в тонкие волокна, которые оканчиваются в мышце или синапсах - местах соединения с другой клеткой. Клетка отделена от окружающей ее среды мембраной, играющей особую роль в образовании и передаче нервного импульса. Внутри клетки концентрация ионов калия намного больше, чем вне клетки, а концентрация ионов натрия - меньше. Благодаря этому на стенке клетки образуется двойной электрический слой. Так как мембрана в состоянии покоя хорошо проницаема для ионов калия и менее проницаема для ионов натрия, между внутренней частью клетки и внешней средой возникает разность потенциалов, составляющая 60-100 милливольт, причем внутренняя часть клетки заряжена отрицательно по отношению к околоклеточной жидкости. При раздражении клетки двойной электрический слой частично разряжается и, когда потенциал покоя снижается до 15-20 милливольт, пропускная способность мембраны по отношению к ионам натрия резко возрастает, и они устремляются внутрь клетки. Как только положительная разность потенциалов между внутренней и внешней поверхностями мембраны достигнута, поток ионов натрия иссякает. В тот же миг открываются каналы для ионов калия, и потенциал сдвигается в отрицательную сторону. Это, в свою очередь, уменьшает проводимость по иону натрия, и потенциал в конце концов достигает значения потенциала покоя. Образующийся в клетке сигнал распространяется по аксону за счет проводимости находящегося внутри него электролита. Если аксон имеет особую изоляцию - миелиновую оболочку, то электрический импульс проходит эти участки значительно быстрее, и общая скорость определяется величиной и количеством неизолированных участков.
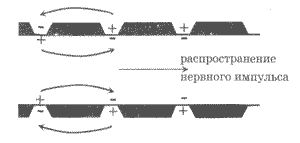
Сальтаторное распространение потенциала действия по миелинизированному волокну
Возбуждение и сокращение мышцы связано с переносом ионов натрия и калия через мембрану, окружающую мышечное волокно. Природа потенциала действия здесь та же, что и в аксоне, только основную роль играют ионы кальция. После возбуждения концентрация кальция резко увеличивается; это вызывает сокращение миофибрилл, состоящих из параллельно расположенных тонких нитей - белка актина и толстых нитей - белка миозина. По окончании сокращения кальций выводится обратно. Движение белковых нитей по отношению друг к другу, лежащее в основе сокращения мышц, нуждается в энергии. Энергию дает гидролиз универсального горючего, необходимого для функционирования биологических систем, - аденозинтрифосфорной кислоты, сокращенно АТФ. Синтезируется АТФ благодаря присутствию на внутренних поверхностях мембраны ферментов, осуществляющих реакцию окисления питательных веществ. Окисление порождает в мембране скачок потенциала. Постепенное сгорание питательных веществ можно уподобить электрохимической реакции, протекающей в топливном элементе. Коэффициент полезного действия энергетических превращений в клетках может достигать 80 процентов.
Источник: powerinfo.ru

